
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
分析 分子式为C9H6O3(只有苯环而不含其它的环),该分子的不饱和度为$\frac{9×2+2-6}{2}$=7,分子中苯环的不饱和度为4,则还含有3个双键或一个双键和一个三键,苯环上有一氯取代物,说明苯环上只含有一种环境的H原子,结合分子的组成分析.
解答 解:分子式为C9H6O3(只有苯环而不含其它的环),该分子的不饱和度为$\frac{9×2+2-6}{2}$=7,分子中苯环的不饱和度为4,则还含有3个双键或一个双键和一个三键,苯环上有一氯取代物,说明苯环上只含有一种环境的H原子,由于含有三个氧原子,则分子中可能含有三个醛基,则结构简式为 ;
;
也可能含有一个C≡C、一个-CHO和2个-OH,则结构简式为 ;所以符合条件的C9H6O3同分异构体有3种;
;所以符合条件的C9H6O3同分异构体有3种;
故选C.
点评 本题考查了同分异构体书写,题目难度中等,有机物的一氯代物只有一种说明分子结构对称,只含有一种环境的H原子,结合分子中的官能团分析,侧重于考查学生的分析能力.


科目:高中化学 来源: 题型:选择题
| 选项 | 离子或分子 | 要求 |
| A | K+、SO42-、Cl-、HS- | c(K+)<c(SO42-) |
| B | Na+、Al3+、Cl-、SO42- | 滴加氨水立即有沉淀产生 |
| C | NH4+、Ba2+、NO3-、CH3COOH | 滴加NaOH溶液立即有气泡产生 |
| D | Fe3+ Na+、NO3-、ClO- | 溶液pH=l |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(SO42-)=c(HS-)=c(K+)>c(OH-)=c(H+) | |
| B. | c(Na+)>c(K+)>c(S2-)>c(H+)>c(OH-) | |
| C. | c(Na+)=c(S2-)+c(HS-)+c(H2S)+c(SO42-) | |
| D. | c(K+)+c(Na+)+c(H+)=c(SO42-)+c(S2-)+c(HS-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
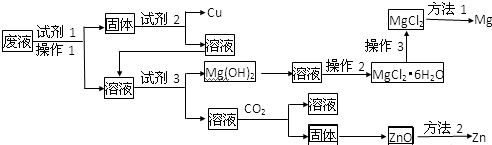
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 准确量取20.00mL高锰酸钾溶液,可选用25mL碱式滴定管 | |
| B. | 将水加热,Kw增大,pH不变 | |
| C. | 用惰性电极电解1L浓度均为2mol/L的AgNO3与Cu(NO3)2的混合溶液,当有0.2 mol 电子转移时,阴极析出6.4g金属 | |
| D. | NaAlO2的水溶液经加热浓缩、蒸干灼烧后能得到NaAlO2固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.2g氧气所含氧分子数为0.2NA | |
| B. | 1L0.1mol/L NaCl 溶液中所含的Na+为0.1NA | |
| C. | 0.012 kg 12C中含有碳原子数约为NA | |
| D. | 24g镁变成镁离子时失去的电子数为2N A |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com