
| A. | 平衡向正反应方向移动 | |
| B. | 平衡向逆反应方向移动 | |
| C. | 平衡不移动,但容器内的压强将增大 | |
| D. | 平衡不移动,且容器内的压强不变 |
科目:高中化学 来源: 题型:选择题
| 分类组合 | 碱 | 酸 | 盐 | 氧化物 |
| A | Na2CO3 | H2SO4 | NaCl | CO2 |
| B | NaOH | HCl | NaHCO3 | H2SiO3 |
| C | NaOH | H2CO3 | CaCl2 | SO2 |
| D | KOH | NaHSO4 | CaCO3 | CO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室制取溴乙烷的主反应如下:
实验室制取溴乙烷的主反应如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解度 | |
| 乙 醇 | 46 | 0.789 | 78.3 | 易溶 |
| 溴乙烷 | 109 | 1.46 | 38.2 | 难溶 |
| 浓硫酸 | 98 | 1.84 | 338.0 | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
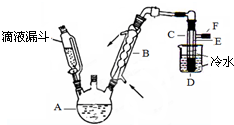 图是实验室用乙醇、硫酸、溴化钠混合反应来制备溴乙烷的装置.反应需要加热,图中省去了加热装置.乙醇、溴乙烷、溴的有关性状参数见表.
图是实验室用乙醇、硫酸、溴化钠混合反应来制备溴乙烷的装置.反应需要加热,图中省去了加热装置.乙醇、溴乙烷、溴的有关性状参数见表.| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g.cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
| 水溶性 | 易溶 | 难溶 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正、逆反应速率都加大,平衡向正反应方向移动 | |
| B. | 正、逆反应速率都没有变化,平衡不发生移动 | |
| C. | 正反应速率加大,逆反应速率减小,平衡向正反应方向移动 | |
| D. | 正反应速率减小,逆反应速率加大,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子的还原性强弱:I->Fe2+>Br- | |
| B. | 当a≥b时,发生的离子反应:2I-+Br2=I2++2Br- | |
| C. | 当3a≤2b时,发生的离子反应:2Fe2++2I-+2Br2=2Fe3++I2+4Br- | |
| D. | 当5a=4b时,反应后的离子浓度之比:c(Fe2+):c(Fe3+):c(Br-)=1:1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com