
三苯甲醇( )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇其合成流程如图1所示,装置如图2所示。
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇其合成流程如图1所示,装置如图2所示。
已知:(Ⅰ)格氏试剂容易水解, (碱式溴化镁);
(碱式溴化镁);
(Ⅱ)相关物质的物理性质如下:
| 物质 | 熔点 | 沸点 | 溶解性 |
| 三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇、苯等有机溶剂 |
| 溴苯 | -30.7°C | 156.2°C | 不溶于水,溶于乙醇、乙醚等多数有机溶剂 |
| 苯甲酸乙酯 | -34.6°C | 212.6°C | 不溶于水 |
| Mg(OH)Br | 常温下为固体 | 能溶于水,不溶于醇、醚等有机溶剂 | |

(1)冷凝管(1分),防止空气中水蒸气进入装置,使格氏试剂水解 (1分);
平衡压强,便于漏斗内试剂滴下(2分);水浴 (1分) 受热均匀,
温度易于控制(1分);
(3)蒸馏或分馏(2分);A(2分);取少量最后一次洗涤液于试管中,滴加AgNO3溶液,若无沉淀生成,则已洗涤干净 (或“滴加酚酞试液,洗涤液未变色”等)。(2分)
(4)90% (2分)
解析试题分析:(1)读图2可得,玻璃仪器B是冷凝管;因为格林试剂容易水解,无水氯化钙是中性干燥剂,主要是防止空气中水蒸气进入装置, 防止格林试剂水解,导致三本甲醇的产量降低;
(2)滴液漏斗具有特殊的结构,使三颈瓶内的压强与漏斗内的压强相等,使所加液体能顺利滴入三颈瓶中;由于水的沸点为100℃,水浴可以控制加热的温度不超过100℃,且可以使反应均匀受热 ,温度易于控制;
(3)根据表中给出的物理性质数据,三苯甲醇、乙醚、溴苯、苯甲酸乙酯是互溶液体混合物,但各组成成分的沸点相差较大,因此粗产品分离的方法是蒸馏或分馏,则操作①是蒸馏或分馏,目的是除去乙醚、溴苯、苯甲酸乙酯等杂质;由于碱式溴化镁能溶于水,不溶于醇、醚等有机溶剂,则操作②的目的是除去碱式溴化镁;由于三苯甲醇不溶于水,溶于乙醇、乙醚等有机溶剂,因此洗涤液最好选择水,不能选择乙醚、乙醇、苯等有机溶液,防止又引入乙醚、乙醇、苯等新的杂质;多余的水可以用无水氯化钙等干燥剂除去,再次蒸馏即可得到纯净的三本甲醇;由于合成流程图中加入氯化铵饱和溶液,沉淀的主要成分是碱式溴化镁, 沉淀具有吸附可溶性离子的性质,则沉淀表面可能吸附着氯离子或铵根离子,根据氯离子的性质可以设计实验方案检验沉淀是否洗涤干净,即取最后一次洗出液于试管中,滴加AgNO3溶液,若无白色沉淀生成,则已经洗涤干净;
(4)由于氢气的体积=100.80mL=0.1008L,标准状况下气体摩尔体积为22.4L·mol-1,n=V/Vm,则氢气的物质的量=0.1008L÷22.4L·mol-1;由于三苯甲醇只含有1个羟基,由于2mol羟基与2molNa发生置换反应,生成1molH2,则1mol三苯甲醇与足量Na反应最多放出0.5mol H2,即三苯甲醇的物质的量是氢气的2倍,则三苯甲醇的物质的量为0.1008L÷22.4L·mol-1×2;由于三苯甲醇的分子式为C19H16O,相对分子质量为260,m=noM,则产品中三苯甲醇的质量为0.1008L÷22.4L·mol-1×2×260g·mol-1=2.34g,由于产品的质量为2.60g,则产品中三苯甲醇的质量分数为2.34g÷2.60g×100%=90%。
考点:考查综合实验及化学计算。


科目:高中化学 来源: 题型:实验题
雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl- 。某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验:
已知:3NO3-+ 8Al + 5OH- + 2H2O 3NH3 + 8AlO2-
3NH3 + 8AlO2-
根据以上的实验操作与现象,该同学得出的结论不正确的是
试样中肯定存在NH4+、Mg2+、SO42-和NO3-
试样中一定不含Al3+
试样中可能存在Na+、Cl-
该雾霾中可能存在NaNO3、NH4Cl和MgSO4
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
1,2-二溴乙烷可做汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18g/cm3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。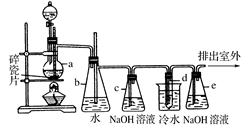
(1)写出本题中制备1,2-二溴乙烷的两个化学反应方程式_____________________________。
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象________________________________________。
(3)容器c中NaOH溶液的作用是: 。
(4)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因: 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
三苯甲醇(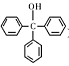 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图所示。
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图所示。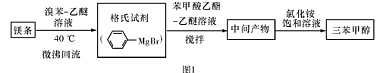
已知:(I)格氏试剂容易水解: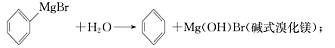
(Ⅱ)相关物质的物理性质如下: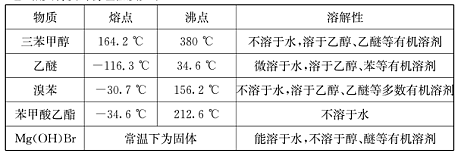
(Ⅲ)三苯甲醇的相对分子质量是260,纯净固体有机物一般都有固定熔点。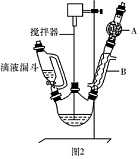
请回答以下问题:
(1)图2中玻璃仪器B的名称: ;装有无水CaCl2的仪器A的作用是 。
(2)图2中滴加液体未用普通分液漏斗而用滴液漏斗的作用是 ;制取格氏试剂时要保持微沸,可以采用 加热方式。
(3)制得的三苯甲醇粗产品中,含有乙醚、溴苯、苯甲酸乙酯等有机物和碱式溴化镁等杂质,可以设计如下提纯方案,请填写如下空白:
其中,①操作为: ;洗涤液最好选用 (从以下选项中选择);
| A.水 | B.乙醚 | C.乙醇 | D.苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
铁触媒(铁的氧化物)是合成氨工业的催化剂。某同学设计了以下两种方案研究铁触媒的组成。
方案一:用下列实验方法测定铁触媒的含铁量,确定其组成。
(1)步骤④中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和 。
(2)若通入Cl2不足量,溶液B中还含有 会影响测定结果。
(3) 若通入Cl2过量且加热煮沸不充分,溶液B中可能含有Cl2。请设计实验方案检验Cl2,完成下列实验报告。
限选试剂:0.1mol L-1酸性KMnO4溶液、紫色石蕊试液、淀粉-KI溶液、0.1mol L-1 KSCN溶液、 品红稀溶液
| 实验操作 | 实验现象与结论 |
| 取适量溶液B于试管中,滴加 ,振荡 ,放置一段时间后,观察现象。 | 若溶液 ,则溶液B中含Cl2; 若溶液 ,则溶液B中不含Cl2。 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学兴趣小组的同学利用下图所示实验装置进行某些气体的制备、性质等实验(图中夹持装置有省略)。请按要求填空:

Ⅰ.探究氯气与氨气的反应
(1)为制取干燥氨气,可将装置C与________(填装置编号)连接;装置C中的烧瓶内固体宜选用________。
a.碱石灰 b.氯化钙 c.五氧化二磷 d.生石灰
(2)装置A、E、E连接可制取纯净、干燥的氯气,则两个E装置内的药品依次是________。
(3)装置F可用于探究氯气与氨气(已知氯气与氨气可发生反应:3Cl2+2NH3=N2+6HCl)的反应。实验时打开开关1、3,关闭2,先向烧瓶中通入________,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体。实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体中的阳离子________。
Ⅱ.探究某些物质的性质
(1)利用装置A、E,可设计实验比较Cl-和Br-的还原性强弱,能证明结论的实验现象是________。
(2)若利用装置A、E进行乙烯与溴水反应的实验,必须对装置A进行的改动是________。
(3)将装置B、C分别与F相连后,进行H2S与SO2反应的实验。F的烧瓶中发生反应的化学方程式为________________;F的烧杯所起的作用是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(13分)某研究性学习小组欲探究Na2CO3溶液与MgCl2溶液反应产生白色沉淀的成分,小组成员做如下实验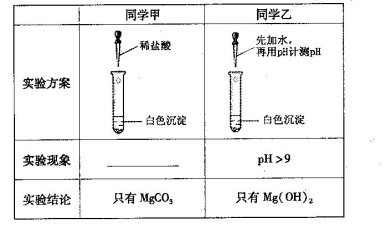
(1)若按所得的结论分析,甲观察到的实验现象是___________________________。
(2)在探究沉淀物成分前,甲、乙都将沉淀物从溶液中分离出来,洗涤并干燥。同学丙认为他们并未将沉淀洗涤干净,请用简单的实验证明丙的观点。
(3)同学丁认为甲结论不合理,理由是Ksp(MgCO3)___Ksp [Mg(OH)2](选填“<”或“>”),所以沉淀物未必是MgCO3。经查阅资料得知:该白色沉淀的组成应为Mgx(OH)y(CO3)z·nH2O。为确定沉
淀物的具体组成,他设计下图装置进行实验(所有夹持装置已省略)。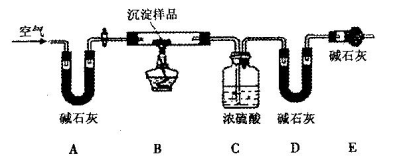
(4)请将丁设计的实验步骤补充完整:
①检查装置气密性;
②先装入药品,并称量相关装置的质量,后连接各装置;
③________________________________________________________;
④停止加热,持续通入空气直至实验结束,再次称量步骤②中相关装置的质量。
(5)装置E中碱石灰的作用是_________________________________________________。
三次实验所得数据如下:(部分数据已换算为相应的物质的量)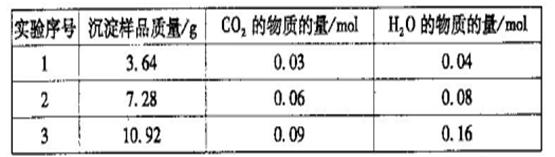
(6)分析实验数据可知,第_________组出现误差较大的数据,应舍去。由实验数据计算
得该白色沉淀物的组成为___________(选填序号)。
a.Mg2(OH)2CO3·3H2O b.Mg(OH)2(CO3)2·3H2O
c.Mg4(OH)2(CO3)3·3H2O d.Mg5(OH)4(CO3)3·2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用作肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的化学方程式如下:
2NH3(g)+CO2(g)??NH2COONH4(s) ΔH<0。
(1)如图所示装置制取氨气,你所选择的试剂是________________________。
(2)制备氨基甲酸铵的装置如图13-7所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是________________________________________________________________________________________________________________________________________________。
液体石蜡鼓泡瓶的作用是________________________________________________________________________。
②从反应后的混合物中分离出产品的实验方法是________________________________________________________________________
(填写操作名称)。为了得到干燥产品,应采取的方法是________(填写选项序号)。
a.常压加热烘干
b.高压加热烘干
c.真空40 ℃以下烘干
③尾气处理装置如图所示。
双通玻璃管的作用:____________;浓硫酸的作用:______________________、__________________________________________________________________。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.173 0 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.500 g。则样品中氨基甲酸铵的物质的量分数为________。[Mr(NH2COONH4)=78,Mr(NH4HCO3)=79,Mr(CaCO3)=100]
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某种粗盐中含有泥沙、Ca2+、Mg2+、Fe3+、SO等杂质。某同学在实验室中设计了用这种粗盐制备精盐的方案如下(用于沉淀的试剂稍过量):
请回答以下问题:
(1)为操作Ⅳ选择所需仪器(用标号字母填写):________。
| A.烧杯 | B.试管 | C.玻璃棒 | D.分液漏斗 E.漏斗 F.酒精灯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com