
分析 (1)①根据n=cV计算出需要碳酸钠的物质的量,再根据m=nM计算出碳酸钠的质量;
②根据配制250mL 0.2mol/L Na2CO3溶液的步骤判断使用仪器;
③根据实验操作方法对c=$\frac{n}{V}$的影响进行判断;
(2)根据n=cV计算出硫酸铜、硫酸的物质的量,再计算出混合液中硫酸根离子的总物质的量,然后根据c=$\frac{n}{V}$计算出稀硫酸的浓度;根据稀释定律,等体积混合后溶液中铜离子、氢离子浓度变为原来的一半.
解答 解:(1)①配制250mL 0.2mol/L Na2CO3溶液,需要碳酸钠的物质的量为:0.2mol/L×0.25L=0.05mol,则需要碳酸钠的质量为:106g/mol×0.05mol=5.3g,
故答案为:5.3 g;
②配制250mL 0.2mol/L Na2CO3溶液的步骤有:计算、称量、溶解、冷却、转移、洗涤、定容等,则需要使用的仪器有:托盘天平、烧杯、胶头滴管、玻璃杯、250mL容量瓶等,使用还缺少的仪器为:小烧杯、玻璃棒、胶头滴管,
故答案为:小烧杯、玻璃棒、胶头滴管;
③A.某同学在定容后观察液面时俯视,导致配制的溶液体积偏小,配制溶液浓度偏高,
故答案为:偏高;
B.在转移时不慎有少量液体流到容量瓶外,导致配制的溶液中溶质的物质的量偏小,溶液浓度偏低,
故答案为:偏低;
C.摇匀后发现液面低于刻度线再加水,导致配制的溶液体积偏大,溶液浓度偏低,
故答案为:偏低;
(2)把amol/L CuS04溶液和bmol/L H2S04溶液等体积混合,根据稀释定律,稀释前后溶质的物质的量不变,则混合液中硫酸根离子浓度为:c(SO42-)=$\frac{1}{2}$c(CuSO4)+$\frac{1}{2}$c(H2SO4)=0.5(a+b)mol/L,等体积混合后溶液中:c(H+)=$\frac{1}{2}$×c(H2SO4)×2=bmol/L,
故答案为:bmol/L;0.5(a+b)mol/L.
点评 本题考查了物质的量浓度的计算、配制一定物质的量浓度的方法,题目难度中等,明确配制一定物质的量浓度的溶液步骤为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的化学计算、化学实验能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 3种单体通过缩聚反应聚合 | B. | 形成该化合物的单体只有2种 | ||
| C. | 其中一种单体为 | D. | 其中一种单体为1,5-二甲基苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将同浓度的NaHA和Na2A溶液等体积混合,所得溶液的pH一定小于7 | |
| B. | 0.1 mol•L-1的NaHA溶液中离子浓度为:c(Na+))>c(HA-)>c(H+>c(A2-)>c(OH-) | |
| C. | 在0.1 mol•L-1的H2A溶液中,c(H+)>0.12 mol•L-1 | |
| D. | 在0.1 mol•L-1的Na2A溶液中,c(A2-)+c(HA-)+c(Na+)=0.3mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
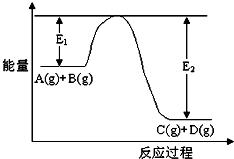 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| B. | 加入氢氧化钠溶液,先产生白色沉淀,后迅速变为灰绿色,最后变为红褐色,一定有Fe2+ | |
| C. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| D. | 加入硝酸银溶液产生白色沉淀,再加稀硝酸,白色沉淀不溶解,一定有Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质熔点:Z>W | B. | 离子半径:X<Y | ||
| C. | 氧化物对应水化物的酸性:X>Z | D. | X和Z可存在于同一离子化合物中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定中涉及的离子方程式为:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O | |
| B. | KMnO4标准溶液常用硫酸酸化,若用HNO3酸化,会使测定结果偏低 | |
| C. | KMnO4标准溶液盛放在酸式滴定管中 | |
| D. | 该实验选择酚酞做指示剂,当待测液颜色由无色变为浅红色时即达到滴定终点 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com