
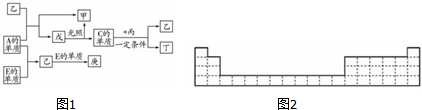
 .
.分析 B可以分别和C、D化合生成乙、丙,且乙、丙每个分子中均含有10个电子,乙、丙都含有氢元素,由于乙、丙为二元化合物,故B为氢气;D、C元素在周期表中位置相邻,由转化关系中,C与氢化物丙可以反应,则C为氧气,故乙为水;原子序数D<C,则D为氮气、丙为NH3,C和D化合可得丁为NO;B和A化合生成甲为氢化物,由转化关系中A与水反应得到化合物甲、戊,戊在光照分解得到甲与氧气,考虑戊为HClO,则A为Cl2、甲为HCl,E为金属与氯气反应生成己,己与E反应生成庚,E为变价金属,则E为Fe、己为FeCl3,庚为FeCl2,据此解答.
解答 解:B可以分别和C、D化合生成乙、丙,且乙、丙每个分子中均含有10个电子,乙、丙都含有氢元素,由于乙、丙为二元化合物,故B为氢气;D、C元素在周期表中位置相邻,由转化关系中,C与氢化物丙可以反应,则C为氧气,故乙为水;原子序数D<C,则D为氮气、丙为NH3,C和D化合可得丁为NO;B和A化合生成甲为氢化物,由转化关系中A与水反应得到化合物甲、戊,戊在光照分解得到甲与氧气,考虑戊为HClO,则A为Cl2、甲为HCl,E为金属与氯气反应生成己,己与E反应生成庚,E为变价金属,则E为Fe、己为FeCl3,庚为FeCl2,
(1)A、C、E对应的元素分别为Cl、O、Fe,在周期表中的位置为: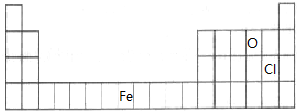 ,
,
故答案为: ;
;
(2)工业上电解饱和食盐水制取氯气,反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-;
(3)由上述分析可知,戊的分子式为HClO.H与N形成的原子个数比为2:1的化合物为N2H4,N原子最外层为8电子结构,其电子式为 ,
,
故答案为:HClO; ;
;
(4)Cl2与NH3常温下发生反应生成HCl甲与N2,该反应的化学方程式为3Cl2+2NH3=6HCl+N2,故答案为:3Cl2+2NH3=6HCl+N2;
(5 )8gFe在氯气中燃烧放出热量QkJ,2molFe反应放出热量为QkJ×$\frac{2mol×56g/mol}{8g}$=14QkJ,故该反应热化学方程式为:2Fe(s)+3Cl2(g)=FeCl3(s)△H=-14QkJ•mol-1,
故答案为:2Fe(s)+3Cl2(g)=FeCl3(s)△H=-14QkJ•mol-1;
(6)实验室配制氯化亚铁溶液,要加入盐酸防止水解,加入铁粉防止氧化,具体实验方法是:向盐酸中加入适量的FeCl2晶体,搅拌溶解,然后加水稀释,并加入少许铁粉,
故答案为:向盐酸中加入适量的FeCl2晶体,搅拌溶解,然后加水稀释,并加入少许铁粉.
点评 本题考查无机物推断、电子式及热化学方程式等常用化学用语、化学实验等知识,乙、丙为10电子物质是推断突破口,对学生的逻辑推理有一定的要求,需要学生熟练掌握元素化合物知识,难度较大,(6)中注意铁盐、亚铁盐溶液的配制.


 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:解答题

| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Co2+ | 7.2 | 9.2 |
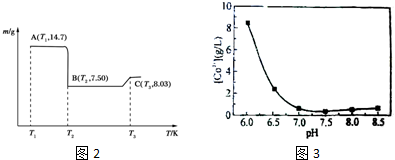
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
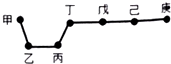
| A. | 单质甲与单质乙充分反应一定都可以生成多种化合物 | |
| B. | 简单气态氢化物的稳定性:庚>己>戊>丁 | |
| C. | 可以通过分别电解熔融的金属氯化物的方法冶炼乙和丙的单质 | |
| D. | 因为庚元素的非金属性最强,所以庚的最高价氧化物对应水化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作和现象 | 结论 |
| A | 切开金属钠,钠表面的银白色会逐渐变暗 | Na在空气中会生成Na2O2 |
| B | 向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4溶液颜色基本不变 | Fe(NO3)2与H2SO4不反应 |
| C | SO2通入酸性KMnO4溶液,溶液褪色 | SO2具有漂白性 |
| D | 将充满NO2的试管倒立在水中,试管内液面约上升至试管容积的$\frac{2}{3}$处;缓慢通入O2,轻轻晃动试管,至液体基本上充满试管 | 从原料的充分利用和减少污染物的排放等方面考虑,该实验对工业生产硝酸有重要启示 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备其单质 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
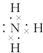 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
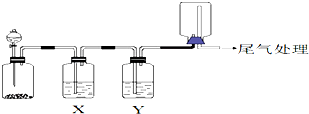
| 选项 | 实验目的 | X中试剂 | Y中试剂 |
| A | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
| B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
| C | CaCO3和稀盐酸制取并收集纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
| D | 氨水与生石灰反应制取并收集纯净干燥的NH3 | 饱和NaOH溶液 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
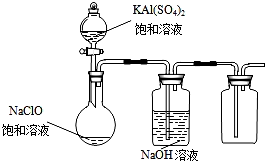 NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.
NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
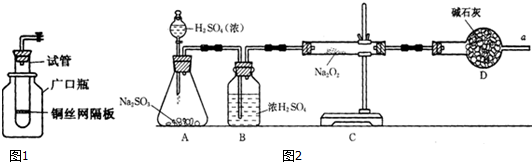
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8.0gCuO和Cu2S的混合物含铜原子个数为0.2NA | |
| B. | 标准状况下,11.2 L乙醇蒸气含共价键数目为4NA | |
| C. | 1mol K与O2完全反应生成K2O、K2O2、KO3的混合物,转移电子数为NA | |
| D. | 1L 0.2 mol•L-1 NH4ClO4溶液中含NH4+数目为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com