
| A. | 升高温度能加快反应速率的主要原因,是增加了反应物分子中活化分子的百分数 | |
| B. | 正反应是吸热反应,达到平衡时,升高温度,v正增大,v逆减小,所以平衡向正反应方向移动 | |
| C. | 一定条件下增大反应物的量,一定会加快反应速率 | |
| D. | 对于任何一个化学反应,用其中任何一种反应物浓度的减小来表示化学反应速率,都是相同的数值 |
分析 A.升高温度增大活化分子百分数;
B.升高温度正逆反应速率都增大;
C.增大固体或纯液体的物质的量反应速率不变;
D.同一反应中,不同物质的速率之比等于计量数比.
解答 解:A.升高温度使部分非活化分子转化为活化分子,所以增大活化分子百分数,反应速率加快,故A正确;
B.升高温度使部分非活化分子转化为活化分子,反应物和生成物中活化分子百分数都增大,所以升高温度正逆反应速率都增大,故B错误;
C.增大固体或纯液体的物质的量,其浓度不变,所以反应速率不变,故C错误;
D.同一反应中,不同物质的速率之比等于计量数比,即其反应速率的数值不一定相同,故D错误.
故选A.
点评 本题考查影响化学平衡和反应速率的因素,把握浓度、温度、压强、催化剂对反应速率的影响即可解答,侧重活化理论的理解及分析的考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

| 实验编号 | 操作 | 现象及结论 |
| a | 加入2mL蒸馏水,再加入10mL 5mol/L Na2S2O8溶液,振荡 | 红色固体逐渐溶解,先慢后快. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验I | 实验II | 实验III | |
| 反应温度/℃ | 800 | 800 | 850 |
| c( A)起始/mol•L-1 | 1 | 2 | 1 |
| c( A)平衡/mol•L-1 | 0.5 | 1 | 0.85 |
| 放出的热量/kJ | a | b | c |
| A. | 化学平衡常数实验III的小于实验I的 | |
| B. | 实验放出的热量关系为b>2a | |
| C. | 实验III 在30min达到平衡,用A表示此段时间的平均反应速率v (A)为0.005mol•L-1•min-1 | |
| D. | 当容器内气体密度不随时间而变化时上述反应已达平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 操作步骤 | 现象 |
| 实验1 | 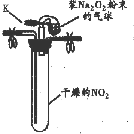 ①按如图组装仪器,打开K,将气球中的Na2O2粉末导入试管中,振荡,充分反应 | 试管内红棕色消失,气球变瘪 |
| ②试管冷却后,打开胶塞,加入5mL蒸馏水 | 未见红棕色气体,试管底部固体全部溶解得澄清溶液 |
| 序号 | 操作步骤 | 现象 |
| 实验2 | 取实验1所得清液, 向其中加入少量MnO2粉末,待不再产生气泡后,静置后取上层清液,再调节此溶液pH至7左右 | / |
| 实验3 | 取实验2后的清液2mL,加入2滴0.1%的酸性KMnO4溶液 |
| 序号 | 操作步骤 | 现象 |
| 实验4 | ①向试管中加入2mL新制FeSO4溶液,再加入10滴0.1mol•L-1NaNO3溶液,振荡,再向试管中加入0.5mL98%的浓硫酸 | 滴入NaNO3溶液,无明显变化,加入浓硫酸后,溶液变棕色 |
| ②向试管中加入2mL新制FeSO4溶液,再加入10滴0.1mol•L-1NaNO2溶液,振荡,再向试管中加入0.5mL98%的浓硫酸 | 加入NaNO2溶液,立即变棕色,加入浓硫酸后,溶液无明显变化 | |
| ③向试管中加入2mL新制FeSO4溶液,再加入10滴实验2后的清液,振荡,再加0.5mL98%的浓硫酸 | 滴加实验2得到的清液后,溶液立即变浅棕色,加入浓硫酸后,溶液变深棕色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲的摩尔体积比乙的摩尔体积小 | |
| B. | 甲的物质的量比乙的物质的量多 | |
| C. | 甲的相对分子质量比乙的相对分子质量小 | |
| D. | 甲的分子数比乙的分子数少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
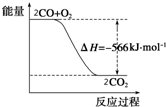 已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1| A. | CO的燃烧热为566 kJ•mol-1 | |
| B. | 如图可表示由CO生成CO2的反应过程中能量变化的过程 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H=-452 kJ/mol | |
| D. | CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何化学反应都伴随着能量的变化 | |
| B. | 升高温度或加入催化剂,可以改变化学反应的反应热 | |
| C. | 化学反应中的能量变化都是以热量的形式体现 | |
| D. | 2CO(g)+O2(g)═2CO2(g)△H<0,则56g CO和32g O2所具有的总能量小于88g CO2所具有的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器里气体的密度为40 g/L | |
| B. | SO3的分解率为30% | |
| C. | 在这10 min内的平均速率为v(O2)=0.05 mol•L-1•min-1 | |
| D. | 化学反应速率:v(Ag2SO4)=v(SO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com