
【题目】查阅资料发现,金属钠不仅能跟氧气和水反应,还能跟多种其他物质发生反应,其中包括与酒精在常温下反应。要研究金属钠跟酒精反应的性质以及它与水反应的异同点,下列的研究方法中用不到的是
A. 实验法 B. 分类法 C. 观察法 D. 比较法
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,△H能正确表示物质的燃烧热的是
A.CO(g)+1/2O2(g)=CO2(g);△H=-283.0kJ/mol
BC(s)+1/2O2(g)=CO(g);△H=-110.5kJ/mol
C.H2(g)+1/2O2(g)=H2O(g);△H=-241.8kJ/mol
D.2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l);△H=-11036kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】味精是烹制菜肴时常用的调味品,其主要成分是谷氨酸钠(化学式为C5H8NO4Na)。谷氨酸钠有鲜味,易溶于水。某品牌味精包装上标注:“谷氨酸钠含量≥80%,NaCl含量≤20%”。某学校化学科研小组现对此味精中NaCl的含量进行测定。
查阅资料:资料表明,谷氨酸钠的存在不影响NaCl含量的测定。该小组同学设计的实验方案如图所示:
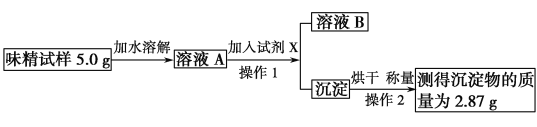
根据上述实验步骤回答下列有关问题:
(1)操作1所需要的玻璃仪器有____________;
(2)用简明扼要的语言描述操作2的过程: ;
(3)加水溶解所得溶液A为50 mL,则溶液A中NaCl的物质的量浓度是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验研究发现,金属与硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与足量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中逐滴加入5mol/L NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列说法不正确的是( )
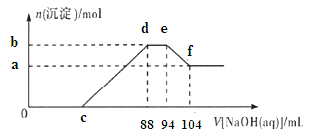
A.稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵
B.b点与a点的差值为0.05 mol
C.c点对应NaOH溶液的体积为40 mL
D.样品中铝粉和铁粉的物质的量之比为10:9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正盐 A 能发生下图所示的反应,图中①~⑧分别代表有关反应中的一种物质(某些物质已略去),其中①、 ②、 ④、 ⑤为无色气体, ⑥为红棕色气体。(已知镁在二氧化碳气体中点燃生成碳单质和氧化镁)

请完成下列各题:
(1)写出化学式 A__________,⑥__________, ⑦_________;
(2)写出下列反应化学方程式:
⑧+⑦→②+③+⑥:___________;①+④→⑤:__________;
(3)⑧→⑤的离子方程式为:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.为了除去粗盐中Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。其中正确的操作顺序是 。
A①④②⑤③ B④①②⑤③ C②⑤④①③ D⑤②④①③ E①②⑤④③
II.实验室里需要纯净的氯化钠溶液,现只有混有硫酸钠、碳酸氢铵的氯化钠固体。某学生设计了如下方案:
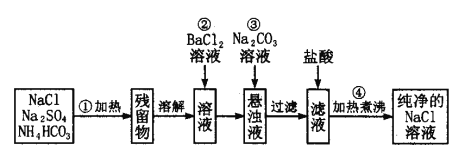
(1)操作①中发生的化学反应方程式为:NH4HCO3![]() NH3↑+CO2↑+H2O↑
NH3↑+CO2↑+H2O↑
则可选择________容器进行加热(选填:试管、量筒、容量瓶、分液漏斗)
(2)操作②反应的化学反应方程式为: ,能否用硝酸钡溶液代替氯化钡 (填“能”或“不能”)原因是: ;
(3)为了达到实验目的,进行操作②后,如何判断溶液中SO42-已除尽,其方法有_________。
A.静置,向上层清液中滴加硫酸钠,若有沉淀生成,则说明原溶液中的SO42-已除尽
B.静置,取上层清液于试管中,滴加硫酸钠,若有沉淀生成,则说明原溶液中的SO42-已除尽
C.静置,向上层清液中滴加氯化钡溶液,若无沉淀生成,则说明原溶液中的SO42-已除尽
D.静置,取上层清液于试管中,滴加氯化钡溶液,若无沉淀生成,则说明原溶液中的SO42-已除尽
E.静置,取上层清液于试管中,滴加硝酸银溶液,若有沉淀生成,则说明原溶液中的SO42-已除尽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组利用下图装置探究高温下用CO还原CuO的固体产物的成分。

已知:①H2C2O4![]() CO↑+CO2↑+H2O
CO↑+CO2↑+H2O
②Cu2O+4NH3·H2O=2[Cu(NH3)2]++3H2O+2OH-
回答下列问题:
(1)实验开始前,首先必须进行装置气密性检查的操作为
(2)装置B的试剂是
(3)为探究其还原产物的成分,某同学提出了如下假设:
假设1:还原产物为Cu2O;
假设2:还原产物为
假设3:还原产物为
(4)F装置中的PdCl2溶液可以吸收多余的CO,反应后溶液变黑(Pd),该反应的化学方程式为 。
(5)为验证还原产物的成分,甲、乙同学设计了两个实验方案。
①甲同学反应前测CuO固体样品的质量为13.0g,反应一段时间后,熄灭D装置的酒精喷灯,并立即熄灭A装置的酒精灯,待D装置中固体冷却后,称得固体的质量为10.6g。
甲同学取少量称量后的固体放入200mL 3.0 mol·L-1的氨水中,充分混合一段时间后,测得溶液的pH没有改变(溶液体积变化忽略不计),甲同学通过信息推测固体的成分为
②乙同学称量E装置反应前后的质量差,计算出CuO的转化率比甲同学计算结果 填(偏小、偏大、不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氢气的燃烧热是285.8KJ/mol,则表示氢气燃烧热的热化学方程式为 ;
(2)1.6g液态化合物N2H4与液态H2O2恰好完全反应生成两种对环境友好的气体,此时放出75KJ的热量,请写出该反应的热化学方程式 ;
(3)已知Ba2++SO42-=BaSO4(s)△H=-aKJ/mol(视a为已知数),请写出稀硫酸与稀Ba(OH)2溶液反应的热化学方程式 ;
(4)已知2NH3(g)![]() N2(g)+3H2(g)△H=+92.4KJ/mol,把1molN2(g)和3molH2充入密闭容器中充分反应,测得放出的热量始终小于92.4KJ。请简述其原因 ;
N2(g)+3H2(g)△H=+92.4KJ/mol,把1molN2(g)和3molH2充入密闭容器中充分反应,测得放出的热量始终小于92.4KJ。请简述其原因 ;
(5)请仔细看图,
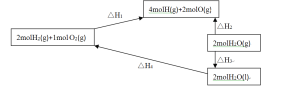
根据盖斯定律,△H4=(用△H1、△H2、△H3表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图与对应的反应情况正确的是

A.含0.0l mol KOH和0.01 mol Ca(OH)2的混合溶液中缓慢通入CO2
B.NaHSO4溶液中逐滴加入Ba(OH)2溶液
C.KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液
D.NaAlO2溶液中逐滴加入盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com