
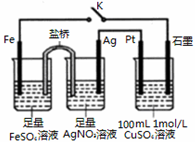
| A. | 盐桥中的电解质可以用KC1 | |
| B. | 闭合K,石墨电极上只生成铜 | |
| C. | 当有0.1mol Fe溶解时,流经电解液的电子个数为1.204×1023 | |
| D. | 导线中流过0.3mol电子时,加入11.1gCu2(OH)2CO3,CuSO4溶液可恢复原组成 |
分析 闭合K时,根据装置可以判断含有盐桥的为原电池装置,其中铁比银活泼为负极,银为正极,硫酸铜为电解装置,与铁相连的石墨为阴极,与银相连的为阳极,据此分析解答.
解答 解:A.由于KCl能和AgNO3产生沉淀,因此盐桥中的电解质不能用KCl,故A错误;
B.闭合K,与铁相连的石墨为阴极,发生还原反应首先Cu2++2e-═Cu,析出Cu,后发生2H++2e-═H2,放出氢气,故B错误;
C.0.1mol铁失去0.2mol电子,但电子不能通过溶液传递,而是经过导线,故C错误;
D.CuSO4溶液中n(Cu2+)=0.1mol,完全消耗时转移电子数为0.2mol,导线中流过03mol e-说明水也参与了电解,电解CuSO4的总反应2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+,溶液中减少的是2Cu和O2(相当于2CuO),需要补充0.1molCuO,电解水的总反应2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,转移电子数为0.1mol,因此消耗0.05mol的H2O,Cu2(OH)2CO3可写为2CuO•H2O•CO2,所以加入0.05mol×222g/mol=11.1g Cu2(OH)2CO3,CuSO4溶液可恢复原组成,故D正确;
故选D.
点评 本题考查原电池、电解池的工作原理,题目难度不大,注意电极的判断和电极方程式的书写,把握原电池、电解池的工作原理,学习中注意相关知识的把握.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子核内有4个质子的元素 | B. | 能与水反应的单质 | ||
| C. | 原子的最外层只有2个电子的元素 | D. | 能形成离子化合物的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石灰水,W1=W2 | B. | 乙醇溶液,W1=W2 | C. | NaHSO4,W1<W2 | D. | CO,W1>W2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜与稀硝酸反应制取NO2 | |
| B. | 碳酸钙与稀盐酸反应制取二氧化碳 | |
| C. | 双氧水在MnO2催化下反应制取氧气 | |
| D. | 氯化铵固体与氢氧化钙固体混合加热制取氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
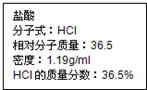 如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20mol•(L•min)-1 | B. | 0.1mol•(L•s)-1 | C. | 0.2mol•(L•s)-1 | D. | 0.4mol•(L•min)-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com