
科目:高中化学 来源: 题型:
 铅蓄电池是典型的可充型电池,它的正负极是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-?2PbSO4+2H2O
铅蓄电池是典型的可充型电池,它的正负极是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-?2PbSO4+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)未用食用油炒咸菜的铁锅如果没有洗净,不久会出现红褐色锈斑.则铁锅的锈蚀属于
(1)未用食用油炒咸菜的铁锅如果没有洗净,不久会出现红褐色锈斑.则铁锅的锈蚀属于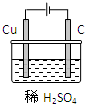

查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学用碳棒、纯铜片、直流电源和稀硫酸为原材料,实现了在通常条件下不能发生的反应:
某同学用碳棒、纯铜片、直流电源和稀硫酸为原材料,实现了在通常条件下不能发生的反应: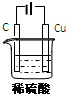

查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东莘县实验高中高三第三次月考化学试卷 题型:填空题
(16分)铅蓄电池是典型的可充型电池,它的正负极是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42-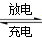 2PbSO4+2H2O[来源:Zxxk.Com]
2PbSO4+2H2O[来源:Zxxk.Com]
请回答下列问题:
(1)、放电时:正极的电极反应式是________________;正极区PH值将________(填“变大”“变小”“不变”);电解液中H2SO4的浓度将变________;当外电路通过1mol电子时,理论上负极板的质量增加________g。
(2)、在完全放电耗尽PbO2和Pb时,若按图连接,电解一段时间后,则在A电极上生成________,B电极上生成________,此时铅蓄电池的正负极的极性将________。

(3)、某同学用碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:
Cu+H2SO4(稀)=CuSO4+H2↑。
请在方框中画出能够实现这一反应的装置图。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com