
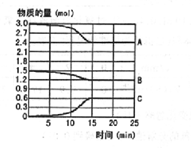
 ŌŚ600”ꏱ£¬½«Ņ»¶ØĮæµÄSO2ŗĶO2³äČėŅ»øöČŻ»ż¹Ģ¶ØĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ£¬·“Ó¦¹ż³ĢÖŠø÷ÖÖĪļÖŹµÄĮæĖꏱ¼äµÄ±ä»ÆČēĶ¼ĖłŹ¾£®
ŌŚ600”ꏱ£¬½«Ņ»¶ØĮæµÄSO2ŗĶO2³äČėŅ»øöČŻ»ż¹Ģ¶ØĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ£¬·“Ó¦¹ż³ĢÖŠø÷ÖÖĪļÖŹµÄĮæĖꏱ¼äµÄ±ä»ÆČēĶ¼ĖłŹ¾£®·ÖĪö £Ø1£©¶žŃõ»ÆĮņŗĶŃõĘų·¢Éś·“Ӧɜ³ÉČżŃõ»ÆĮņ£¬·“Ó¦ŹĒæÉÄę·“Ó¦£¬ŌŖĖŲ»ÆŗĻ¼Ū½µµĶµÄĪļÖŹµĆµ½µē×Ó×öŃõ»Æ¼Į·¢Éś»¹Ō·“Ó¦£»
£Ø2£©·“Ó¦ĪļĪļÖŹµÄĮæĖę·“Ó¦½ųŠŠ¼õŠ”£¬Éś³ÉĪļĪļÖŹµÄĮæŌö“ó£¬Ņ»¶ØŹ±æĢ²»ŌŁ±ä»Æ£¬·“Ó¦“ļµ½Ę½ŗāדĢ¬£¬ŅĄ¾Ż±ä»ÆĪļÖŹµÄĮæÖ®±ČŗĶ»Æѧ·½³ĢŹ½¼ĘĮæŹżÖ®±Č¼ĘĖć·ÖĪö£¬·“Ó¦ĖŁĀŹV=$\frac{”÷c}{”÷t}$£»
£Ø3£©Ķ¼Ļó·ÖĪöæÉÖŖ£¬ĪļÖŹĪļÖŹµÄĮæ²»±äĖµĆ÷ÕżÄę·“Ó¦ĖŁĀŹĻąĶ¬£¬·“Ó¦“ļµ½Ę½ŗāדĢ¬£»
£Ø4£©ÉżĪĀ”¢Ōö“óŃ¹Ē攢Ōö“óÅØ¶Č”¢¼ÓČė“߻ƼĮµČæÉŅŌŌö“ó·“Ó¦ĖŁĀŹ£®
½ā“š ½ā£ŗ£Ø1£©£©SO2ŗĶO2ŌŚÉĻŹöĢõ¼žĻĀ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ2SO2+O2$\frac{\underline{“߻ƼĮ}}{”÷}$2SO3£¬·“Ó¦ÖŠŃõĘųÖŠŃõŌŖĖŲ»ÆŗĻ¼Ū0¼Ū±ä»ÆĪŖ-2¼Ū£¬ŌŖĖŲ»ÆŗĻ¼Ū½µµĶĖłŅŌŃõĘų×öŃõ»Æ¼Į£¬
¹Ź“š°øĪŖ£ŗ2SO2+O2$\frac{\underline{“߻ƼĮ}}{”÷}$2SO3£»O2£»
£Ø2£©·“Ó¦ĪļĪļÖŹµÄĮæĖę·“Ó¦½ųŠŠ¼õŠ”£¬Éś³ÉĪļĪļÖŹµÄĮæŌö“ó£¬Ņ»¶ØŹ±æĢ²»ŌŁ±ä»Æ£¬·“Ó¦“ļµ½Ę½ŗāדĢ¬£¬·“Ó¦ÖŠĪļÖŹµÄ±ä»ÆĮæĪŖ£ŗAĪŖ3.0mol-2.4mol=0.60mol£¬ĪļÖŹµÄĮæ±ä»ÆĪŖ£ŗ1.5mol-1.2mol=0.3mol£¬CĪļÖŹµÄĮæ±ä»ÆĪŖ£ŗ0.60mol£¬ŌņA”¢B”¢CĪļÖŹµÄĮæÖ®±Č=0.60£ŗ0.30£ŗ0.60mol=2£ŗ1£ŗ2£¬ŌņAĪŖSO2£¬BĪŖO2£¬CĪŖSO3£¬ÓĆAµÄÅØ¶Č±ä»Æ±ķŹ¾øĆ·“Ó¦ŌŚ0”«15minÄŚµÄ»Æѧ·“Ó¦ĖŁĀŹ=$\frac{\frac{0.60mol}{2L}}{15min}$=0.02mol/L•min£¬
¹Ź“š°øĪŖ£ŗSO2£»0.02£»
£Ø3£©Ķ¼Ļó·ÖĪöæÉÖŖ£¬ĪļÖŹĪļÖŹµÄĮæ²»±äĖµĆ÷ÕżÄę·“Ó¦ĖŁĀŹĻąĶ¬£¬·“Ó¦“ļµ½Ę½ŗāדĢ¬£¬15minŗóA”¢B”¢CµÄĪļÖŹµÄĮæ²»ŌŁøıäµÄŌŅņŹĒ“ļµ½ĮĖ»ÆŃ§Ę½ŗāדĢ¬£¬
¹Ź“š°øĪŖ£ŗ“ļµ½ĮĖ»ÆŃ§Ę½ŗāדĢ¬£»
£Ø4£©ÓūĢįøßøĆ·“Ó¦µÄ»Æѧ·“Ó¦ĖŁĀŹ£¬æɲÉČ”µÄ“ėŹ©ŹĒ¼ÓČė“߻ƼĮ”¢ÉżĪĀ”¢¼ÓŃ¹µČ£¬
¹Ź“š°øĪŖ£ŗ¼ÓČė“߻ƼĮ£¬ÉżøßĪĀ¶Č£»
µćĘĄ ±¾Ģāæ¼²éĮĖĶ¼Ļó·ÖĪö”¢Ó°Ļģ»Æѧ·“Ó¦ĖŁĀŹµÄŌŖĖŲ”¢»Æѧ·“Ó¦ĖŁĀŹ¼ĘĖćµČÖŖŹ¶µć£¬ÕĘĪÕ»ł“”ŹĒ½āĢā¹Ų¼ü£¬ĢāÄæ½Ļ¼ņµ„£®


 æŖŠÄĶÜדŌŖ²āŹŌ¾ķĻµĮŠ“š°ø
æŖŠÄĶÜדŌŖ²āŹŌ¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | »ÆŗĻĪļµēĄėŹ±£¬Éś³ÉµÄŃōĄė×ÓŹĒĒāĄė×ӵďĒĖį | |
| B£® | »ÆŗĻĪļµēĄėŹ±£¬Éś³ÉµÄŅõĄė×ÓŹĒĒāŃõøłĄė×ӵďĒ¼ī | |
| C£® | »ÆŗĻĪļµēĄėŹ±£¬Éś³É½šŹōŃōĄė×ÓŗĶĖįøłĄė×ӵďĒŃĪ | |
| D£® | NH4ClµÄµēĄė·½³ĢŹ½ŹĒ£ŗNH4ClØTNH4++Cl-£¬NH4+²»ŹĒ½šŹōŃōĄė×Ó£¬ĖłŅŌNH4Cl²»ŹĒŃĪ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | C2H6 | B£® | C2H2 | C£® | C3H6 | D£® | C6H6 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĪåÖÖ | B£® | Į½ÖÖ | C£® | ČżÖÖ | D£® | ĖÄÖÖ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
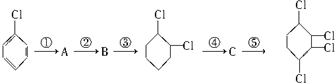
 £¬B£ŗ
£¬B£ŗ £¬C£ŗ
£¬C£ŗ £®
£® +2NaOH$”ś_{”÷}^{“¼}$
+2NaOH$”ś_{”÷}^{“¼}$ +2NaCl+2H2O£®
+2NaCl+2H2O£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com