
【题目】
(1)上图四个装置常用于实验室制取气体,其中制取氯气选用的装置为_______________,反应的离子方程式为______________________。
(2)从下图装置左端分别通入氯气或二氧化硫时,装置B中观察到的现象是否相同________(填“相同”或“不相同”);装置A反应后溶液均褪色,如何利用褪色后的溶液判断是何种气体使其褪色______________(写出简要的实验步骤);

(3)装置F中盛放的溶液为______________(填溶质的化学式);若装置E中试剂为铁丝,则通入氯气与铁丝充分反应的化学方程式为______________;
(4)当通入足量SO2完全反应后,向C中滴加淀粉溶液,无明显现象。该反应的离子方程式为______________。
【答案】甲 4H++2Cl-+MnO2![]() 2H2O + Cl2↑+Mn2+ 不相同 分别取褪色后的A溶液于试管中,加热,若溶液变红色,说明是二氧化硫使其褪色,若不变红,说明是氯气使其褪色 NaOH 2Fe+3Cl2
2H2O + Cl2↑+Mn2+ 不相同 分别取褪色后的A溶液于试管中,加热,若溶液变红色,说明是二氧化硫使其褪色,若不变红,说明是氯气使其褪色 NaOH 2Fe+3Cl2 ![]() 2FeCl3 I2+SO2+2H2O=2I-+4H++SO42-
2FeCl3 I2+SO2+2H2O=2I-+4H++SO42-
【解析】
(1). 实验室通常在甲装置中利用二氧化锰和浓盐酸加热制取氯气,反应的离子方程式为:4H++2Cl-+MnO2![]() 2H2O + Cl2↑+Mn2+,故答案为:甲;4H++2Cl-+MnO2
2H2O + Cl2↑+Mn2+,故答案为:甲;4H++2Cl-+MnO2![]() 2H2O + Cl2↑+Mn2+;
2H2O + Cl2↑+Mn2+;
(2). 氯气与水反应生成HCl和HClO,HCl可以使紫色石蕊试液变红,HClO具有强氧化性,可以漂白石蕊试液使溶液褪色,所以通入氯气后B装置的现象是先变红后褪色,SO2与水反应生成H2SO3,H2SO3具有酸性,可以使紫色石蕊试液变红但不能褪色,所以从装置左端分别通入氯气或二氧化硫时,装置B中观察到的现象不相同,因HClO具有强氧化性,将品红溶液漂白后加热不能恢复为红色,而SO2使品红溶液褪色后加热可以恢复为红色,所以检验的方法是:分别取褪色后的A溶液于试管中,加热,若溶液变红色,说明是二氧化硫使其褪色,若不变红,说明是氯气使其褪色,故答案为:不相同;分别取褪色后的A溶液于试管中,加热,若溶液变红色,说明是二氧化硫使其褪色,若不变红,说明是氯气使其褪色;
(3). 无论是氯气还是二氧化硫都有毒性,可以选用NaOH溶液吸收尾气,防止污染空气,若装置E中试剂为铁丝,则通入氯气与铁丝充分反应生成氯化铁,化学方程式为:2Fe+3Cl2 ![]() 2FeCl3,故答案为:NaOH;2Fe+3Cl2
2FeCl3,故答案为:NaOH;2Fe+3Cl2 ![]() 2FeCl3;
2FeCl3;
(4). 将二氧化硫通入碘水中反应生成硫酸和碘化氢,反应的离子方程式为:I2+SO2+2H2O=2I-+4H++SO42-,所以通入足量SO2完全反应后,向C中滴加淀粉溶液,无明显现象,故答案为:I2+SO2+2H2O=2I-+4H++SO42-。


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】[化学―有机化学基础]
化合物M是二苯乙炔类液晶材料的一种,最简单的二苯乙炔类化合物是![]() 。以互为同系物的单取代芳香烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
。以互为同系物的单取代芳香烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
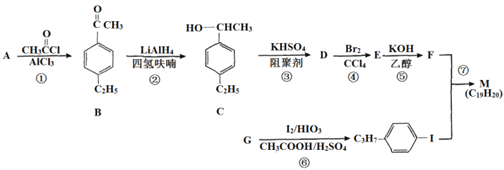
回答下列问题:
⑴G的结构简式为_____________________
⑵C中含有的官能团名称是________
⑶反应②的反应类型是_________,反应⑥的反应类型是______
⑷反应⑤的化学方程式为________________________
⑸能同时满足下列条件的B的同分异构体有____种(不考虑立体异构),其中核磁共振氢谱为5组峰,且峰面积之比为6:2:2:l:l的是_________(写结构简式)。
①苯环上有两个取代基 ②能发生银镜反应
⑹参照上述合成路线,设计一条由苯乙烯和甲苯为起始原料制备![]() 的合成路线_________。
的合成路线_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
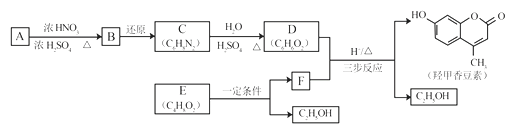
【题目】羟甲香豆素是一种治疗胆结石的药物,合成路线如下图所示:
已知: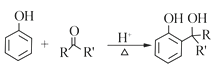
RCOOR'+R'OH![]() RCOOR'+ R'OH(R、R'、R'代表烃基)
RCOOR'+ R'OH(R、R'、R'代表烃基)
(1)A属于芳香烃,其结构简式是__________________。B中所含的官能团是_____________。
(2)C→D的反应类型是___________________。
(3)E属于酯类。仅以乙醇为有机原料,选用必要的无机试剂合成E,写出有关化学方程式:______________________________。
(4)已知:2E![]() F+C2H5OH。F所含官能团有
F+C2H5OH。F所含官能团有![]() 和___________。
和___________。
(5)以D和F为原料合成羟甲香豆素分为三步反应,写出有关化合物的结构简式:
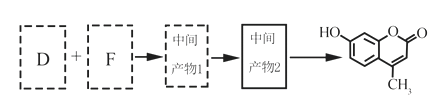 D:______________、F:______________、中间产物1:______________、中间产物2:______________
D:______________、F:______________、中间产物1:______________、中间产物2:______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施或事实不能用勒夏特列原理解释的是( )
A. 新制的氯水在光照下颜色变浅
B. NO2和N2O4平衡混合气缩小体积加压后颜色先变深后变浅一点
C. 氢气和碘蒸气反应达平衡后加压颜色加深
D. 硫酸工业上SO2氧化成SO3,通入过量的空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中属于盐类水解反应的是( )
①NH3+H2O![]() NH4++OH-②HCO3-+H2O
NH4++OH-②HCO3-+H2O![]() H2CO3-+OH-
H2CO3-+OH-
③HCO3-+H2O![]() H3O++CO32-④Fe3++3HCO3-
H3O++CO32-④Fe3++3HCO3-![]() Fe(OH)3↓+3CO2↑
Fe(OH)3↓+3CO2↑
⑤NH4++2H2O![]() NH3·H2O+H3O+
NH3·H2O+H3O+
A. ②④⑤ B. ②③④⑤ C. ①③⑤ D. ①②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2是化石燃料燃烧的主要产物。
(1)将含002molCO2和001molCO的混合气体通入有足量Na2O2固体的密闭容器中,同时不断地用电火花点燃,充分反应后,固体质量增加______g。
(2)已知:2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol,键能Eo-o=499.0kJ/mol。
①反应:CO(g)+O2(g)![]() CO2(g)+O(g)的△H=______kJ/mol。
CO2(g)+O(g)的△H=______kJ/mol。
②已知2500K时,①中反应的平衡常数为0.40,某时刻该反应体系中各物质浓度满足:c(CO)·c(O2)=c(CO2) ·c(O),则此时v(正)_____(填“>""<"或"=”)v(逆)。
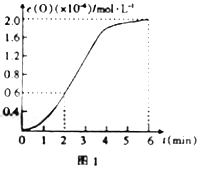
③已知1500℃时,在密闭容器中发生反应:CO2(g)![]() CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1所示,则0~2min内,CO2的平均反应速率v(CO2)=______。
CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1所示,则0~2min内,CO2的平均反应速率v(CO2)=______。
(3)在某密闭容器中发生反应:2CO2(g)![]() 2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图2所示。
2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图2所示。
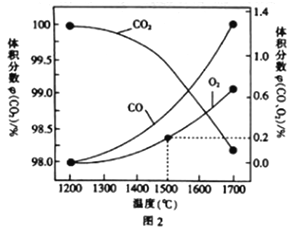
①恒温恒容条件下,能表示该可逆反应达到平衡状态的有___(填字母).
A.CO的体积分数保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内,消耗CO的浓度等于生成CO2的浓度
②分析图2,若1500℃时反应达到平衡状态,且容器体积为1L,则此时反应的平衡常数K=____(计算结果保留1位小数)。
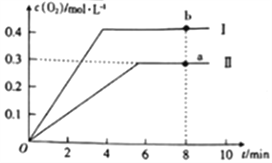
③向2L的恒容密闭容器中充入2molCO2(g),发生反应:2CO2(g)![]() 2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II所示。图中曲线I表示相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是______;a、b两点用CO浓度变化表示的净反应速率关系为va(CO)_____(填“>”“<”或“=”)vb(CO)。
2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II所示。图中曲线I表示相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是______;a、b两点用CO浓度变化表示的净反应速率关系为va(CO)_____(填“>”“<”或“=”)vb(CO)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电池的说法不正确的是( )
A.锌锰干电池中,锌电极是负极B.手机上用的锂离子电池属于二次电池
C.氢氧燃料电池可把化学能转化为电能D.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.毛发和蚕丝的主要成分都是蛋白质B.天然气和沼气的主要成分都是甲烷
C.油脂的皂化反应、蛋白质水解都属于取代反应D.古代的蜡是高级脂肪酸酯,属于高分子聚合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积0.1mol/L的氨水中逐滴滴加0.1mol/L的盐酸,溶液中pH与pOH[pOH=-lgc(OH-)]的变化关系如右图所示。下列说法正确的是
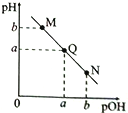
A. M点:(pH+pOH) >2a
B. N点溶液加水稀释, 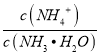 增大
增大
C. M、N两点的溶液中:[cM(NH4+)-cN(C1-)] <[cM(Cl-)-cN(NH4+)]
D. 线段MN上各点所示溶液中水的电离程度最大的不是Q点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com