
【题目】I.氢气在工业合成中应用广泛。
(1)通过下列反应可以制备甲醇
①CO(g)+2H2(g)=CH3OH(g) △H=-90.8kJ·mol-1
②CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41.3kJ·mol-1
请写出由CO2和H2制取甲醇的热化学方程式:______________________。
Ⅱ.CH4可以消除氮氧化物的污染,主要反应原理为
CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g) △H=-868.7kJ·mol-1
(2)在3.00L密闭容器中通入1 mol CH4和2 mol NO2,在一定温度下进行上述反应,反应时间(t)与容器内气体总压强(p)的数据见下表:
反应时间t/min | 0 | 2 | 4 | 6 | 8 | 10 |
总压强P/×100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
由表中数据计算,0~4min内v(NO2)=___________,该温度下的平衡常数K=___________。
(3)在一恒容装置中通入一定量CH4和NO2,测得在相同时间内和不同温度下,NO2的转化率如下图。则下列叙述正确的是___________。

A 若温度维持在200℃更长时间,NO2的转化率将大于19%
B 反应速率b点的v(逆)>e点的(逆)
C 平衡常数:c点=d点
D b点反应未达到平衡
(4)利用氨气可以设计高能环保燃料电池,用该电池电解含有NO3-的碱性工业废水,在阴极产生N2。阴极的电极反应式为______________________;在标准状况下,当阴极收集到13.44LN2时,理论上消耗NH3的体积为___________。
(5)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在 NH4HCO3溶液中c(NH4+)___________c(HCO3-)(填“>”“<”或“=”);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=___________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11)
NH3·H2O+H2CO3的平衡常数K=___________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11)
【答案】![]()
![]() 0.1mol·L-1·min-1 6.75 AD
0.1mol·L-1·min-1 6.75 AD ![]() 44.8L > 1.25×10-3
44.8L > 1.25×10-3
【解析】
(1)由盖斯定律计算可得;
(2)由题给数据建立三段式,依据压强之比等于物质的量比计算0~4min和平衡时各物质的物质的量,运用化学反应速率和化学平衡常数公式计算;
(3)由图可知,温度400℃、500℃转化率最大,反应达到平衡状态,400℃之前反应没有到达平衡状态,该反应为放热反应,500℃之后升高温度,平衡向逆反应方向移动,NO2的转化率降低;
(4)由题给信息可知,NO2-在阴极上得电子发生还原反应生成N2;由得失电子数目守恒计算理论上消耗NH3的体积;
(5)由电离常数大小判断溶液中HCO3-和NH4+的水解程度;找出化学平衡常数与水的离子积常数和电离常数的关系计算。
(1)由盖斯定律可知,①+②得CO2和H2制取甲醇的热化学方程式CO2(g)+3H2(g)= CH3OH(g)+H2O(g),△H=△H1+△H2=(-90.8kJ·mol-1)+(+41.3kJ·mol-1)=-49.5kJ·mol-1,故答案为:CO2(g)+3H2(g)= CH3OH(g)+H2O(g)△H=-49.5kJ·mol-1;
(2)设0~4min内CH4的消耗量为x,由题意建立如下三段式:
CH4(g)+2NO2(g)![]() CO2(g)+2H2O(g)+N2(g)
CO2(g)+2H2O(g)+N2(g)
起(mol) 1 2 0 0 0
变(mol) x 2x x 2x x
4min(mol)1—x 2—2x x 2x x
由![]() =
=![]() 得关系式
得关系式![]() =
=![]() ,解得x=0.6mol,则0~4min内v(NO2)=
,解得x=0.6mol,则0~4min内v(NO2)=![]() =
=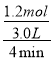 =0.1mol·L-1·min-1;由表中数据可知,8min时反应达到平衡,设CH4的消耗量为y,由题意建立如下三段式:
=0.1mol·L-1·min-1;由表中数据可知,8min时反应达到平衡,设CH4的消耗量为y,由题意建立如下三段式:
CH4(g)+2NO2(g)![]() CO2(g)+2H2O(g)+N2(g)
CO2(g)+2H2O(g)+N2(g)
起(mol) 1 2 0 0 0
变(mol) y 2y y 2y y
平(mol) 1—y 2—2y y 2y y
由![]() =
=![]() 得关系式
得关系式![]() =
=![]() ,解得y=0.75mol,平衡时c(CH4)、c(NO2)、c(CO2)、c(H2O)、c(N2)分别为
,解得y=0.75mol,平衡时c(CH4)、c(NO2)、c(CO2)、c(H2O)、c(N2)分别为![]() mol/L、
mol/L、![]() mol/L、
mol/L、![]() mol/L、
mol/L、![]() mol/L、
mol/L、![]() mol/L,则化学平衡常数K=
mol/L,则化学平衡常数K=![]() =
=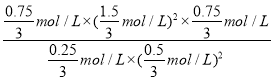 =6.75,故答案为:0.1mol·L-1·min-1;6.75;
=6.75,故答案为:0.1mol·L-1·min-1;6.75;
(3)A、图中200℃时,反应没有到达平衡,向正反应进行,温度维持在200℃更长时间,NO2的转化率将大于19%,故正确;
B、温度越高,化学反应速率越大,由图可知b点反应温度低于e点反应温度,则b点的v (逆) <e点的v (逆),故错误;
C、该反应为放热反应,升高温度,平衡向逆反应方向移动,化学平衡常数减小,由图可知c点反应温度低于d点反应温度,则化学平衡常数c>d,故错误;
D、由图可知,温度400℃、500℃转化率最大,反应达到平衡状态,400℃之前反应没有到达平衡状态,则b点反应未达到平衡,故正确;
AD正确,故答案为:AD;
(4)由题给信息NO3-→N2可知,N元素化合价由+3价→0价,NO2-在阴极上得电子发生还原反应生成N2,电极反应式为2NO3-+6H2O+10e-=N2↑+12OH-;标况下,13.44LN2的物质的量为![]() =0.6mol,NH3在阳极上失电子发生氧化反应生成N2,由得失电子守恒可得n(NH3)×3=n(N2)×10,解得n(NH3)=2mol,体积为2mol×22.4L/mol=44.8L,故答案为:2NO3-+6H2O+10e-=N2↑+12OH-;44.8;
=0.6mol,NH3在阳极上失电子发生氧化反应生成N2,由得失电子守恒可得n(NH3)×3=n(N2)×10,解得n(NH3)=2mol,体积为2mol×22.4L/mol=44.8L,故答案为:2NO3-+6H2O+10e-=N2↑+12OH-;44.8;
(5)由NH3.H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7可知在溶液中NH3.H2O的电离大于H2CO3的电离,则溶液中HCO3-的水解程度大于NH4+,所以NH4HCO3溶液中c(NH4+) 大于c(HCO3-);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=![]() =
=![]() =
=![]() ==1.25×10-3,故答案为:>;1.25×10-3。
==1.25×10-3,故答案为:>;1.25×10-3。


科目:高中化学 来源: 题型:
【题目】有机物X(C4H6O5)广泛存在于许多水果内,尤以苹果、葡萄、西瓜、山楂内为多,该化合物具有如下性质:
(1)1molX与足量的金属钠反应产生1.5 mol气体
(2)X与醇或羧酸在浓H2SO4和加热的条件下均生成有香味的产物
(3)X在一定程度下的分子内脱水产物(不是环状化合物)可和溴水发生加成反应
根据上述信息,对X的结构判断正确的是 ( )
A.X中肯定有碳碳双键
B.X中可能有三个羟基和一个-COOR官能团
C.X中可能有三个羧基
D.X中可能有两个羧基和一个羟基
查看答案和解析>>
科目:高中化学 来源: 题型:
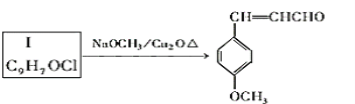
【题目】阿司匹林是一种历史悠久的解热镇痛药,对预防血栓和脑梗有很好的作用,M是一种防晒剂,它们的结构简式分别为: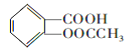 和
和
由A出发合成路线如图:
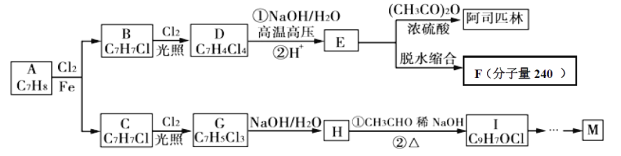
已知:
I. E的俗称水杨酸,学名2-羟基苯甲酸
II. 
III、![]()
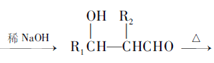
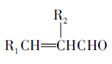 +H2O
+H2O
根据以上信息回答下列问题
(1)M中含氧官能团的名称_____________,阿司匹林的核磁共振氢谱中显示有________种不同化学环境的氢原子。
(2)写出H→Ⅰ过程中的反应类型_______、______,F的结构简式_____________。
(3)写出D→E转化过程中①(D + NaOH)的化学方程式__________________。
(4)由H→I的过程中可能出现多种副产物,其中一种分子式为C16H12O2Cl2,写出该副产物的结构简式_______________。
(5)阿司匹林有多种同分异构体,符合下列条件的所有同分异构体有________种。
a 苯环上有3个取代基 b 仅属于酯类,能发生银镜反应,且每摩该物质反应时最多能生成4molAg,其中苯环上的一氯代物有两种的结构简式____________________。(任写出一种)
(6)写出由Ⅰ到M的合成路线(用流程图表示)。
示例CH2=CH2![]() CH3CH2Br
CH3CH2Br ![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
化合物F(异戊巴比妥)是临床常用的镇静催眠药物,其合成路线如下(部分反应条件和试剂略):
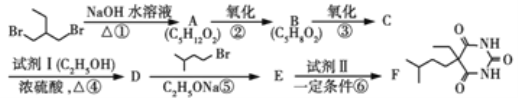
已知:
(1)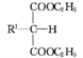 +R2Br+C2H5ONa
+R2Br+C2H5ONa![]()
 +C2H5OH+NaBr(R1,R2代表烷基)
+C2H5OH+NaBr(R1,R2代表烷基)
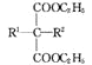
(2)R—COOC2H5+![]()
![]()
![]() (其他产物略)
(其他产物略)
请回答下列问题:
(1)试剂Ⅰ的化学名称是____,化合物B的官能团名称是______,第④步的化学反应类型是____。
(2)第①步反应的化学方程式是____________________。
(3)第⑤步反应的化学方程式是_____________________。
(4)试剂Ⅱ的相对分子质量为60,其结构简式是 ___________________。
(5)化合物B的一种同分异构体G与NaOH溶液共热反应,生成乙醇和化合物H。H在一定条件下发生聚合反应得到高吸水性树脂,该聚合物的结构简式是_________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列推理正确的是
A. 铝粉在氧气中燃烧生成Al2O3,铁丝在氧气中燃烧也生成Fe2O3
B. 铁能从硫酸铜溶液中置换出铜,钠也能从硫酸铜溶液中快速置换出铜
C. 铝片表面易形成致密的氧化膜,钠块表面也易形成致密的氧化膜
D. 钠与氧气、水等反应时钠均作还原剂,金属单质参与氧化还原反应时金属均作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于自然界中氮循环(如图)的说法不正确的是:
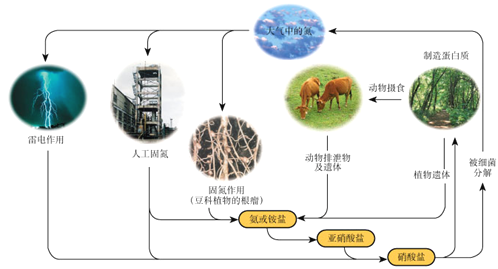
A. 氮元素均被氧化
B. 工业合成氨属于人工固氮
C. 含氮无机物和含氮有机物可相互转化
D. 碳、氢、氧三种元素也参与了氮循环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,向20mLcmol·L-1KOH溶液中滴加0.1mol·L-1HCOOH溶液,混合溶液中水电离的氢氧根离子浓度与滴加甲酸(弱酸)溶液体积(V)的关系如图所示。下列说法正确的是
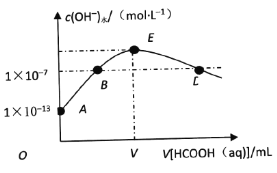
A. 上述KOH溶液的浓度c=0.01mol·L-1
B. B点对应的溶液中:c(K+)=c(HCOO-)
C. E点对应的溶液中:c(OH-)>c(H+)=c(HCOOH)
D. 若D点对应的甲酸溶液体积为V1mL,则HCOOH电离平衡常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
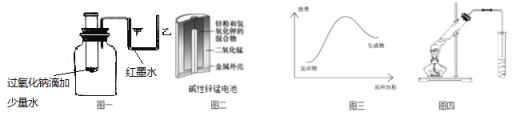
A.图一可表示模拟反应的能量变化,反应后左侧液面上升,右侧液面下降
B.图二所示电池中,MnO2的作用是催化剂
C.图三可表示需加热的放热反应
D.图四可用于乙酸和乙醇的酯化反应,小试管中是饱和碳酸钠溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com