
| A. | 在试管中加入2mL10%的CuSO4溶液,然后加入4至6滴10%的NaOH溶液振荡,再加入几滴乙醛溶液加热煮沸,可以检验乙醛分子中的醛基 | |
| B. | 将无水乙醇加热至170℃时,可以制得乙烯 | |
| C. | 用氢氧化钠溶液清洗盛过苯酚的试管 | |
| D. | 向溴乙烷中滴加硝酸酸化的AgNO3溶液,以检验其中的溴元素 |
分析 A.反应应在碱性条件下进行,碱不足;
B.乙醇制取乙烯需要浓硫酸作催化剂;
C.苯酚具有酸性,能和NaOH发生中和反应;
D.溴乙烷中不含自由移动的溴离子,应该先发生消去反应或取代反应生成溴离子,然后用硝酸酸化的硝酸银溶液检验溴离子.
解答 解:A.反应应在碱性条件下进行,碱不足,应加过量的氢氧化钠,故A错误;
B.乙醇制取乙烯需要浓硫酸作催化剂,没有浓硫酸作催化剂不能制取乙烯,故B错误;
C.苯酚具有酸性,能和NaOH发生中和反应,从而除去苯酚,故C正确;
D.溴乙烷中不含自由移动的溴离子,应该先发生消去反应或取代反应生成溴离子,然后加入硝酸酸化的硝酸银溶液,根据是否含有淡黄色沉淀检验溴离子,从而确定是否含有溴元素,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,侧重考查卤代烃检验、乙烯的制取、醛基的检验等知识点,明确实验原理是解本题关键,注意醛基检验必须在碱性条件下、卤代烃中卤元素的检验必须在酸性条件下,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②⑥ | C. | ④⑤ | D. | ①⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2在正极发生氧化反应 | |
| B. | 供电时的总反应是 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | |
| C. | 氢氧燃料电池中反应放出的热量转变为电能 | |
| D. | 电解质溶液中OH-向负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
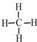 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 组号 | 温度(℃) | CaCO3的状态 | 盐酸浓度(mol/L) |
| A | 20 | 块状 | 3 |
| B | 30 | 小颗粒 | 2 |
| C | 30 | 块状 | 4 |
| D | 30 | 小颗粒 | 4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ;25℃、101kPa时该气态氢化物热值为5×104kJ•kg-1,则其标准燃烧热为-1300kJ/mol;
;25℃、101kPa时该气态氢化物热值为5×104kJ•kg-1,则其标准燃烧热为-1300kJ/mol;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com