
【题目】下列情况会对人体健康造成较大危害的是
A. 使用SO2漂白银耳
B. 自来水中通入少量Cl2进行消毒杀菌
C. 用食醋清洗热水瓶胆内壁附着的水垢
D. 用小苏打焙制糕点
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】现有以下物质:①食盐水②二氧化碳③盐酸④蔗糖⑤熔融的硫酸钾⑥氧气⑦纯醋酸⑧金属铜⑨碳酸氢钠固体⑩氢氧化钠固体。请回答下列问题(用序号填写)
(1)能导电的是 __________________________________;
(2)属于电解质的是________________,属于非电解质的是__________________。
(3)写出相关电解质的电离方程式 ____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.4mol·L-1—元酸HA与0.2mol·L-1NaOH溶液等体积混合后,所得溶液pH>7,溶液部分微粒组分及浓度如下图所示。下列说法正确的是

A. HA是弱酸
B. 图中未表示出的微粒的浓度小于0.lmol/L
C. 该混合溶液中:c(HA)+c (X)=c(Na+)
D. 图中M表示HA,Y表示OH-,Z表示H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸亚铁(FeCO3)是一种重要的工业盐。某学习小组对用FeSO4制备FeCO3
资料显示:FeCO3:白色结晶,难溶于水;干燥品在空气中稳定,湿品暴露在空气中缓慢氧化生成红棕色的水合氧化铁FeO(OH。
(1)实验探究Ⅰ
实 验 Ⅰ | 操作 | 现象 |
| 1、混合后出现白色絮状沉淀,振荡,部分沉淀呈灰绿色,无气泡产生 2、放置5-8分钟,灰绿色沉淀逐渐增多,最终变成红褐色 |
①生成FeCO3离子方程式:_________________________________。
②反应过程中可能生成Fe(OH)2的依据是__________________________________。
③取沉淀离心、充分洗涤,加足量稀硫酸,沉淀溶解且有气泡产生,证明白色沉淀中含有CO32-;此时溶液中存在的金属阳离子有__________________________________。
(2)实验探究Ⅱ
实验Ⅱ | 操作 | 现象 |
| 1、混合后,试管中出现白色颗粒状浑浊,片刻后有大量气泡产生 2、振荡,粘附在试管内壁的白色颗粒状浑浊变红棕色,且越来越多;20分钟后,白色浑浊明显沉降 |
①经检验,试管中白色颗粒状浑浊是FeCO3,请结合化学用语从平衡角度解释产生大量气泡的原因______________________________________________。
②分析现象认为:实验Ⅱ所得固体中FeCO3的含量比实验Ⅰ多。支持该结论的操作及现象如下:分别两种沉淀离心过滤、洗涤、干燥后称取等质量的两种固体,___________________则结论成立。
(3)实验探究Ⅲ
实验Ⅱ | 操作 | 现象 |
| 1、混合后,试管中出现白色颗粒状浑浊,片刻后有大量气泡产生 2、一段时间后将带有气球(排尽空气)的胶塞塞紧试管,振荡后放置5小时,气球膨胀,试管中沉淀物始终保持白色 |
实验改进的意图是____________。
(4)综合以上实验,下列说法正确的是__________
a.用NaHCO3制得FeCO3纯度高的原因之一是因为NaHCO3溶液碱性弱
b.用1 L 1.0 mol/L NaHCO3与足量FeSO4溶液反应理论上可制备116 g FeCO3
c.湿品FeCO3在空气中缓慢氧化的方程式为 4FeCO3+O2+6H2O=4Fe(OH)3+4CO2
d.工业上用NH4HCO3和FeSO4反应可制备纯度更高的FeCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A和a是生活中常见的两种有机物,可用于制备安眠药苯巴比妥Q,合成过程如下:
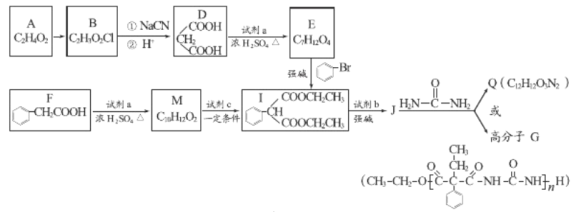
已知: 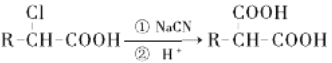
(1)A的官能团名称为_________。
(2)A→B的反应类型为_________。
(3)D→E的反应方程式为_________________________。
(4)写出F符合下列条件的同分异构体的结构简式_________。
①遇Fe3+溶液显紫色 ②发生银镜反应 ③苯环上的一溴代物有两种
(5)J与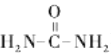 在催化剂作用下既可以生成Q,又可以生成G,写出生成G的化学方程式 _________________________________。
在催化剂作用下既可以生成Q,又可以生成G,写出生成G的化学方程式 _________________________________。
(6)下列说法正确的是 _________。
a.E与M互为同系物
b.B水解酸化后的产物可以发生加聚反应
c.用试剂b制备乙烯的条件是NaOH的醇溶液、加热
d.Q的结构简式是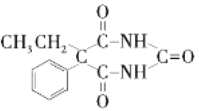
(7)试剂c为酯类,核磁共振氢谱有两组吸收峰,与M反应生成I和a,此反应为取代,则试剂c的结构简式为 _________。
(8)写出以CH2=CH-CH=CH2和E为主要原料制备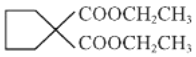 的流程_____________________________________________________________。
的流程_____________________________________________________________。
(无机试剂自选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料。已知:SeO2在常温下是白色的晶体,熔点为340-350℃,则SeO2晶体属于____晶体,SeO2中Se原子采取的杂化类型为_____________。(2)卤素单质及其化合物在工农业生产和生活中都有重要的用途。
①同主族元素的电负性大小存在一定的规律,卤族元素(F、CI、Br、I)中,电负性最,小的是____,基态Br原子的价电子排布为___________________。
②硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物,如BF3能与NH3反应生成BF3·NH3。BF3分子的分子构型为____,BF3-NH3中BF3与NH3之间通过结合____(填“离子键”、“配位键”或“氢键”)。
(3)某金属是抗癌药物中的明星元素,其晶体中金属原子的堆积方式如右图所示。Mg/mol金属原子的配位数为___________;N已知金属的摩尔质量为Mg/mol,原子半径为rpm,阿伏加德罗常数为NA,则该晶胞的密度为____g/cm3。(用含M、NA、r的代数式表示,lpm=1.0×10—10cm)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是
A. K值不变,平衡可能移动 B. K值变化,平衡一定移动
C. 平衡移动,K值可能不变 D. 平衡移动,K值一定变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某透明溶液中含有以下离子中的几种H+、Na+、Fe3+、Cu2+、NH4+、Mg2+、Cl-、NO3-、SO42-、CH3COO-、I-、OH-,且只含有四种阳离子,为确定离子种类设计实验如下(已知氧化性:HNO3>Fe3+>I2) :
①取溶液少许滴加1~2滴紫色石蕊试液后溶液呈红色;
②取100mL溶液,滴加1.0mol/L的NaOH溶液至520mL时恰好完全反应,加热后共收集到0.448L(标准状况下)气体(假设气体全部逸出),同时产生沉淀。将沉淀过滤,洗涤,灼烧后得到一种黑色和白色的固体混合物,称得质量为14.0g。下图为滴加NaOH溶液过程图像(纵坐标为生成沉淀的质量,横坐标为滴加NaOH溶液体积)。继续向滤液中滴加足量的BaCl2溶液,又产生白色沉淀46.6g;

③另取100mL原溶液通入标准状况下1.12LCl2,恰好完全反应,加入四氯化碳后,振荡静置后分层,下层呈现紫色(已知:Cl2+2I-=2Cl-+I2);
④在③中滴加硝酸酸化的硝酸银溶液后生成不溶于稀硝酸的白色沉淀。
结合以上实验现象和数据可知:
(1)溶液中一定不能大量存在____________。
(2)填写表中空格(可以不填满): __________。
离子种类 | ||||||||
离子浓度(mol/L) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com