
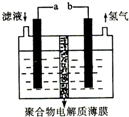
 将H2S通人FeCl3溶液中,过滤后将反应液加人电解槽中电解(如图所示)电解后的溶液还可以循环利用.该方法可用于处理石油炼制过程中产生的H2S废气.下列有关说法正确的是( )
将H2S通人FeCl3溶液中,过滤后将反应液加人电解槽中电解(如图所示)电解后的溶液还可以循环利用.该方法可用于处理石油炼制过程中产生的H2S废气.下列有关说法正确的是( )| A、过滤得到的沉淀可能是FeS和S |
| B、若有0.20mol的电子转移,一定能得到2.24L的氢气 |
| C、可以用Fe与外接电源的a极相连 |
| D、与a极相连的电极反应为Fe2+-e-=Fe3+ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、pH=0溶液:Fe3+、Mg2+、SO42-、NO3- |
B、滴加甲基橙显红色的溶液:Ca2+、K+、MnO4-、 |
| C、1mol?L-1KI溶液中:Cu2+、Fe3+、NO3-、Cl- |
| D、c(NH3?H2O)=1mol?L-1的溶液中:NH4+、Al3+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两种溶液中由水电离出来的c(H+)不相同 |
| B、中和相同体积的两种酸溶液所需NaOH的物质的量分别为a和b,则a<b |
| C、加入足量的铁粉,放出H2的体积相同 |
| D、分别用蒸馏水稀释m倍和n倍,两溶液pH仍相同,则m=n |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、24gO2分子和24gO3分子所含的氧原子数目相等 |
| B、标准状况下,22.4L水中含有的水分子数为NA |
| C、标准状况下,22.4L氯化氢所含的原子数为NA |
| D、1molN2所含有的原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
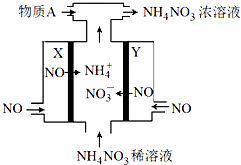 电解NO制备 NH4NO3的工作原理如图所示,X、Y皆Pt电极,为使电解产物全部转化为NH4NO3,需补充物质A.下列说法正确的是
电解NO制备 NH4NO3的工作原理如图所示,X、Y皆Pt电极,为使电解产物全部转化为NH4NO3,需补充物质A.下列说法正确的是| A、物质A为NH3 |
| B、X电极为电解池阳极 |
| C、Y电极上发生了还原反应 |
| D、Y电极反应式为NO-3e-+4OH-═NO3-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫化钠溶液呈碱性:S2-+2H2O?H2S+2OH- |
| B、亚硫酸溶液呈酸性:H2SO3═2H++SO32- |
| C、FeCl3溶液呈酸性:Fe3++3H2O?Fe(OH)3+3H+ |
| D、氯化铝溶液跟过量的氨水反应:Al3++4OH-═[Al(OH)4]- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、TNT(炸药)爆炸时部分化学能转化为热能 |
| B、电解饱和食盐水时部分化学能转化为电能 |
| C、镁条燃烧时部分化学能转化为光能 |
| D、植物光合作用时部分光能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 氧化物 | 酸 | 碱 | 盐 | |
| A. | Fe3O4 | CH3COOH | NH3?H2O | (NH4)2SO4 |
| B. | SO2 | H2SO4 | NaOH | Na2O2 |
| C. | CO | HNO3 | Cu2(OH)2CO3 | FeSO4 |
| D. | H2O | NaHSO4 | Ba(OH)2 | Na2CO3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com