
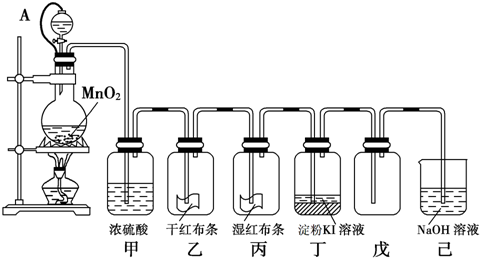
 HCl+HClO.
HCl+HClO.
| ||
| ||


科目:高中化学 来源:不详 题型:单选题
| A.Si→SiO2→H2SiO3→Na2SiO3 |
| B.Al→Al2O3→Al(OH)3→NaAlO2 |
| C.N2→NH3→NO→NO2→HNO3→NO2 |
| D.S→SO3→H2SO4→SO2→Na2SO3→Na2SO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.“水滴石穿”是溶解了CO2的雨水与CaCO3长期作用生成了可溶性Ca(HCO3)2的缘故 |
| B.若将NaOH溶液盛放在滴瓶中,玻璃塞不易打开,是NaOH与瓶中的CO2反应导致瓶内气体减少形成“负压”的缘故 |
| C.严格的讲,通风橱窗是一种不负责任的防污染手段,因为实验产生的有害气体没有得到转化或吸收被排到空气中了 |
| D.赏心悦目的雕花玻璃是用氢氟酸对玻璃进行蚀刻而制成的 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓硫酸 | B.饱和食盐水 | C.水 | D.新制氯水 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③⑤②④ | B.②①③④⑤ | C.②④①③⑤ | D.③①②⑤④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
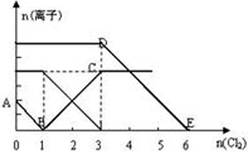
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
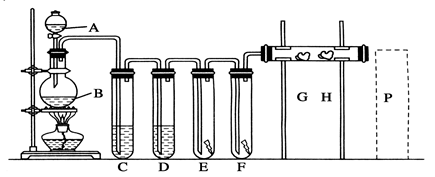
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com