
| A. | $\frac{39m}{V}$mol•L-1 | B. | $\frac{2m}{39V}$mol•L-1 | C. | $\frac{m}{39V}$mol•L-1 | D. | $\frac{m}{78V}$mol•L-1 |
分析 根据n=$\frac{m}{M}$计算出mg 钾离子的物质的量,然后根据硫酸钾的化学式计算出硫酸根离子的物质的量,最后根据c=$\frac{n}{V}$计算出溶液中硫酸根离子的物质的量浓度.
解答 解:mg 钾离子的物质的量为:n(K+)=$\frac{mg}{39g/mol}$=$\frac{m}{39}$mol,
根据硫酸钾的化学式K2SO4可知,n(SO42-)=$\frac{1}{2}$n(K+)=$\frac{m}{39}$mol×$\frac{1}{2}$=$\frac{m}{78}$mol,
则溶液中SO42-的物质的量浓度为:c(SO42-)=$\frac{\frac{m}{78}mol}{VL}$=$\frac{m}{78V}$mol/L,
故选D.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量与物质的量浓度、摩尔质量之间的关系为解答关键,注意掌握物质的量浓度的概念及表达式.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 有机物都能燃烧生成二氧化碳和水,且受热不易分解 | |
| B. | 有机物大多数难溶于水而易溶于汽、四氯化碳等有机溶剂 | |
| C. | 有机物都是非电解质且熔点、沸点较低 | |
| D. | 有机化学反应都较复杂,且副反应多,反应速率慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 甲 | 乙 | |
| A | 物质A的分子数 | 一个A分子的质量 |
| B | 标准状况下气体摩尔体积 | 标准状况下气体体积 |
| C | 固体体积 | 固体密度 |
| D | 非标准状况下物质的质量 | 物质的摩尔质量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②④ | C. | ③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 断裂3NA个碳碳双键时,放出3260kJ的热量 | |
| B. | 消耗336L O2时,放出6520kJ的热量 | |
| C. | 转移30NA个电子时,放出3260kJ的热量 | |
| D. | 生成3NA个气态水分子时,放出3260kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
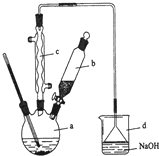 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
 +Br2$\stackrel{铁粉}{→}$
+Br2$\stackrel{铁粉}{→}$ +HBr.
+HBr.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com