
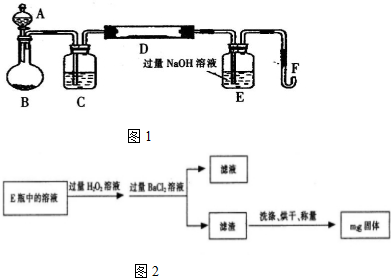
分析 (1)装置中生成的氧气含有水蒸气需要在通入玻璃管前除去水蒸气,选用浓硫酸进行干燥;铁矿石和氧气反应生成氧化铁和二氧化硫,E装置是吸收二氧化硫气防止污染环境;
(2)Ⅱ中加入过量H2O2溶液发生的反应是过氧化氢氧化亚硫酸根离子生成硫酸根离子,过氧化氢被还原为水;
(3)依据配制一定体积溶液的操作步骤分析,需要在250mL容量瓶中配制,高锰酸钾溶液具有强氧化性需要盛在酸式滴定管中;
(4)样品质量为m1g,依据流程分析可知得到硫酸钡沉淀为m2g,依据硫元素守恒计算硫元素质量得到硫元素的质量分数;依据滴定实验消耗的高锰酸钾物质的量结合反应的定量关系计算亚铁离子物质的量,依据铁元素守恒得到样品中含有的铁元素质量分数;
解答 解:(1)装置中生成的氧气含有水蒸气需要在通入玻璃管前除去水蒸气,选用浓硫酸进行干燥;铁矿石和氧气反应生成氧化铁和二氧化硫,E装置是吸收二氧化硫气防止污染环境;
故答案为:浓硫酸,吸收二氧化硫;
(2)Ⅱ中加入过量H2O2溶液发生的反应是过氧化氢氧化亚硫酸根离子生成硫酸根离子,过氧化氢被还原为水,反应的离子方程式为:H2O2+SO32-═SO42-+H2O;
故答案为:H2O2+SO32-═SO42-+H2O;
(3)依据配制一定体积溶液的操作步骤分析,需要在250mL容量瓶中配制,高锰酸钾溶液具有强氧化性需要盛在酸式滴定管中;
故答案为:250mL容量瓶,酸式滴定管;
(4)样品质量为m1g,依据流程分析可知得到硫酸钡沉淀为m2g,硫元素物质的量=硫酸钡物质的量=$\frac{{m}_{2}g}{233g/mol}$=$\frac{{m}_{2}}{233}$mol;依据硫元素守恒计算硫元素质量得到硫元素的质量分数=$\frac{\frac{{m}_{2}}{233}mol×32g/mol}{{m}_{1}g}$×100%=$\frac{32{m}_{2}}{233{m}_{1}}$100%;
依据滴定实验消耗的高锰酸钾物质的量结合反应的定量关系计算亚铁离子物质的量,反应的离子方程式为:5Fe2++MnO4-+8H+═Mn2++5Fe3++4H2O;
设亚铁离子物质的量为X,
25mL溶液消耗高锰酸钾物质的量=c mol/L×Vml×10-3L/mol=cV×10-3mol
5Fe2+~MnO4-
5 1
X cV×10-3mol
X=5cV×10-3mol
所以250mL溶液中含铁元素物质的量5cV×10-2mol
依据铁元素守恒得到样品中含有的铁元素质量分数=$\frac{5cV×1{0}^{-2}mol×56g/mol}{{m}_{1}g}$×100%=$\frac{2.8cV}{{m}_{1}}$×100%
故答案为:$\frac{2.8cV}{{m}_{1}}$×100%;
点评 本题考查了物质性质的实验探究方法和实验分析判断,过程中的定量计算关系是解题关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 35 | B. | 37 | C. | 36 | D. | 35.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 混合气体的密度不变 | |
| B. | 容器内的总压强不随时间变化 | |
| C. | 容器中各组分的体积分数不随时间变化 | |
| D. | 单位时间内生成2n mol的AB,同时生成n mol的B2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SeO4的氧化性比Cl2弱 | B. | SeO2的氧化性比SO2弱 | ||
| C. | H2SeO4的氧化性比H2SeO3强 | D. | 浓H2SeO4的氧化性比HNO3强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加KI溶液时,当有2molI-参加反应,则生成1mol白色沉淀 | |
| B. | 通入SO2后溶液逐渐变成无色,体现了SO2的氧化性 | |
| C. | 通入SO2时,SO2与I2反应,I2作还原剂,H2SO4是氧化产物 | |
| D. | 上述实验条件下,物质的还原性:Cu+>I->SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
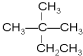 ④癸烷 ⑤CH3COOH
④癸烷 ⑤CH3COOH  ⑦
⑦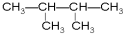 ⑧
⑧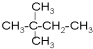 ⑨丙烷
⑨丙烷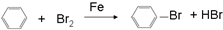 ;
; ;
;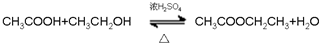 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | 30 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 H2AsO3-+OH(用离子方程式表示),该溶液中c(H2AsO3-)>c(AsO33-)(填”>”、“<”或“=”).
H2AsO3-+OH(用离子方程式表示),该溶液中c(H2AsO3-)>c(AsO33-)(填”>”、“<”或“=”).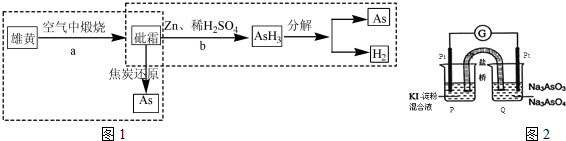
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com