
【题目】金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”.
(1)Ti基态原子的电子排布式为
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物.电负性:C(填“>”或“<”,下同)B;第一电离能:NO,原因是 .
(3)月球岩石﹣﹣玄武岩的主要成分为钛酸亚铁(FeTiO3).FeTiO3与80%的硫酸反应可生成TiOSO4 . SO42﹣的空间构型为形,其中硫原子采用杂化,写出SO42﹣的一种等电子体的化学式:
(4)Ti的氧化物和CaO相互作用能形成钛酸盐CaTiO3 , CaTiO3的晶体结构如图所示(Ti4+位于立方体的顶点).该晶体中,Ti4+和周围个O2﹣相紧邻. 
(5)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型.晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响.由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71gcm﹣3 , 晶胞边长为4.28×10﹣10 m,则FexO中x=(用代数式表示,不要求算出具体结果).
【答案】
(1)1s22s22p63s23p63d24s2
(2)>;>;N原子中的2p轨道处于半充满状态,更稳定
(3)正四面体;sp3;ClO4﹣等
(4)12
(5)![]() ﹣
﹣ ![]()
【解析】解:(1)Ti原子核外电子数为22,根据能量最低原理,核外电子排布式为:1s22s22p63s23p63d24s2 , 所以答案是:1s22s22p63s23p63d24s2;(2)同周期自左而右元素电负性增大,故电负性C>B,N原子中的2p轨道处于半充满状态,更稳定,第一电离能高于同周期相邻元素的,故第一电离能N>O,
所以答案是:>;>;N原子中的2p轨道处于半充满状态,更稳定;(3)SO42﹣中S原子孤电子对数= ![]() =0,价层电子对数=4+0=0,为正四面体结构,杂化轨道数目为4,S原子杂化方式为sp3;原子数目相同、价电子总数相同的微粒互为等电子体,SO42﹣的一种等电子体的化学式:ClO4﹣等,
=0,价层电子对数=4+0=0,为正四面体结构,杂化轨道数目为4,S原子杂化方式为sp3;原子数目相同、价电子总数相同的微粒互为等电子体,SO42﹣的一种等电子体的化学式:ClO4﹣等,
所以答案是:正四面体;sp3;ClO4﹣等;(4)CaTiO3的晶体结构中Ti4+位于立方体的顶点,由晶胞结构图可知,体心为Ca2+ , 面心为O2﹣ , ).该晶体中每个顶点Ti4+与面心的O2﹣相邻,每个顶点为8个晶胞共用,每个面为2个晶胞共用,晶体中,Ti4+和周围紧相邻O2﹣数目为 ![]() =12,
=12,
所以答案是:12;(5)FexO晶体的晶胞结构为NaCl型,所以每个晶胞中含有4个O原子,有4个“FexO”,再根据m=ρV可知:4× ![]() g=5.71gcm﹣3×(4.28×10﹣8 cm)3 , 解得:x=
g=5.71gcm﹣3×(4.28×10﹣8 cm)3 , 解得:x= ![]() ﹣
﹣ ![]() ,
,
所以答案是: ![]() ﹣
﹣ ![]() .
.


科目:高中化学 来源: 题型:
【题目】室温下,0.1mol/L的H2A溶液体系中,含A粒子的分布系数(平衡时某粒子的浓度占各粒子浓度之和的分数)与溶液 pH的关系如图所示.下列说法不正确的是( ) 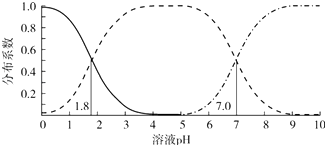
A.室温下,HA﹣的电离常数Ka2=1.0×10﹣7
B.室温下,0.1mol/L的NaHA溶液显酸性
C.室温下,0.2mol/L的H2A与0.1mol/L的NaOH溶液等体积混合,溶液pH=1.8
D.0.1mol/L的Na2A溶液中c(OH﹣)=c(H+)+c(HA﹣)+2c(H2A)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列溶液中,各组离子一定能够大量共存的是( )
A.使酚酞试液变红的溶液:Na+、Cl﹣、SO ![]() 、Fe3+
、Fe3+
B.常温下 ![]() =0.1mol?L﹣1的溶液:K+、Na+、SiO
=0.1mol?L﹣1的溶液:K+、Na+、SiO ![]() 、NO
、NO ![]()
C.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、MnO ![]() 、Cl﹣
、Cl﹣
D.澄清透明溶液:Al3+、Na+、SO ![]() 、HCO3﹣
、HCO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”是当今社会提出的一个新概念。在“绿色化学”工艺中,理想状态是反应物中原子全部转化为欲制得产物,即原子利用率100%。以下反应最符合绿色化学的是( )
A.CH2=CH2与HCl反应制取CH3CH2ClB.乙醇和浓硫酸共热制乙烯
C.苯与液溴反应制取溴苯D.乙醇与金属钠反应制取乙醇钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在日常生活、生产中应用广泛.
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,工业上利用NaClO 和NaOH的混合溶液将Fe(OH)3氧化性制备高铁酸钠,反应的化学方程式为;高铁酸钠能用作新型净水剂的原理是;(用离子方程式表示).
(2)氧化铁红颜料跟某些油料混合,可以制成防锈油漆.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下: 
①酸溶过程中发生反应的化学方程式为 , , ;“滤渣A”主要成份的化学式为 .
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+ , 而本身被氧化为H2SO4 , 请写出该反应的离子方程式;
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关合金的性质叙述不正确的是 ( )
A.合金的熔点比它的各成分金属的熔点低
B.合金一定是金属熔合而成的
C.合金的硬度和强度一般比纯金属高
D.硬铝、黄铜、钢均为合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数,下面叙述正确的是( )
A.标准状况下,11.2L CCl4所含分子数为0.5NA
B.1L 1mol/L的氯化钠溶液中,所含离子数为NA
C.常温下,4.4g CO2和N2O(不反应)混合物中所含有的原子数为0.3NA
D.1mol Cl2与足量的铁发生反应,转移的电子总数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 6.02×1023个碳原子的质量为1g
B. 钠原子的摩尔质量为23g
C. HCl的摩尔质量等于6.02×1023个HCl分子的质量
D. Na2O2的摩尔质量为78g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列溶液中,各组离子一定能够大量共存的是( )
A.能使广泛pH试纸显红色的溶液:K+、Ba2+、Cl﹣、Br﹣
B.含有大量Al3+的溶液:Na+、Cl﹣、HCO3﹣、SO42﹣
C.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42﹣、S2﹣、SO32﹣
D.常温下 ![]() =1012的溶液:Fe2+、Mg2+、NO3﹣、Cl﹣
=1012的溶液:Fe2+、Mg2+、NO3﹣、Cl﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com