
下列叙述正确的是( )
A.无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其c(H+)·c(OH-)=
1×10-14
B.c(H+)等于1×10-7mol·L-1的溶液一定是中性溶液
C.0.2 mol·L-1CH3COOH溶液中的c(H+)是0.1 mol·L-1CH3COOH溶液中的c(H+)的2倍
D.任何浓度的溶液都可以用pH来表示其酸性的强弱
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
A、B、C、D均为中学化学中常见的物质,它们之间转化关系如下图(部分产物已略去):
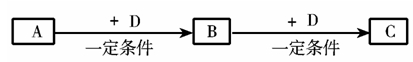
试回答:
(1)若D是具有氧化性的单质,则属于主族的金属A为 (填元素符号)
(2)若D是金属,C溶液在储存时应加入少量D,其理由是(用必要的文字和离子方程式表示) ;D在潮湿的空气中易发生吸氧腐蚀,写出腐蚀时原电池正极的电极反应式 。
(3)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B。请写出B转化为C的所有可能的离子方程式 。化合物B经过一系列反应可以得到单质E,将一定质量的Mg和E 的混合物投入500mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则固体混合物中Mg的质量为 ;NaOH溶液的物质的量浓度为 。


查看答案和解析>>
科目:高中化学 来源: 题型:
某一元弱酸(用HA表示)在水中的电离方程式是:HA H++A-,回答下列问题:
H++A-,回答下列问题:
(1)向溶液中加入适量NaA固体,以上平衡将向 (填“正”或“逆”)反应方向移动,理由是 。
(2)若向溶液中加入适量NaCl溶液,以上平衡将向 (填“正”或“逆”)反应方向移动,溶液中c(A-)将 (填“增大”“减小”或“不变”),溶液中c(OH-)将 (填“增大”“减小”或“不变”)。
(3)在25℃下,将amol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显 性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,某密闭容器里发生如下反应:
CO(g)+H2O(g) CO2(g)+H2(g)(正反应为放热反应),当反应达到平衡时,测得容器中各物质的物质的量均为n mol。欲使H2的物质的量浓度增大1倍,在其他条件不变时,下列措施中采用的是( )
CO2(g)+H2(g)(正反应为放热反应),当反应达到平衡时,测得容器中各物质的物质的量均为n mol。欲使H2的物质的量浓度增大1倍,在其他条件不变时,下列措施中采用的是( )
①升高温度 ②增大压强 ③再通入n mol CO2和n mol H2 ④再加入2n mol CO和2n mol H2O(g)
A.①② B.②④
C.③④ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在一定条件下有CO(g)+H2O(g) CO2(g)+H2(g)。在某一容积为2 L的密闭容器内,加入0.2 mol的CO和0.2 mol的H2O,在催化剂存在的条件下,高温加热,发生如下反应:CO(g)+H2O(g)====CO2(g)+H2(g)
CO2(g)+H2(g)。在某一容积为2 L的密闭容器内,加入0.2 mol的CO和0.2 mol的H2O,在催化剂存在的条件下,高温加热,发生如下反应:CO(g)+H2O(g)====CO2(g)+H2(g)
ΔH=akJ·mol-1反应达平衡后,测得c(CO)∶c(CO2)=3∶2,下列说法正确的是
( )
A.反应放出的热量为0.04akJ
B.平衡时H2O的转化率为40%
C.若将容器的体积压缩为1 L,有利于该反应平衡正向移动
D.判断该反应达到平衡的依据是CO、H2O、CO2、H2的浓度都相等
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,将某一元酸HA和NaOH溶液等体积混合,实验信息如下:
| 实验编号 | c(HA) / mol·L-1 | c(NaOH) / mol·L-1 | 反应后溶液pH |
| 甲 | 0.1 | 0.1 | pH=9 |
| 乙 | c1 | 0.2 | pH=7 |
下列判断不正确的是( )
A.c1一定大于0.2
B.HA的电离方程式是HA H++A-
H++A-
C.乙反应后溶液中:c(Na+)=c(HA)+c(A-)
D.甲反应后溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.实验室有一瓶失去标签的某白色固体,已知其成分可能是碳酸或亚硫酸的钠盐或钾盐,且其成分单一。现某化学小组通过如下步骤来确定其成分:
(1)阳离子的确定:
实验方法及现象: 。
结论:此白色固体是钠盐。
(2)阴离子的确定:
①取少量白色固体于试管中,然后向试管中加入稀盐酸,白色固体全部溶解,产生无色气体,此气体能使溴水褪色。
②要进一步确定其成分需补做如下实验:取适量白色固体配成溶液,取少许溶液于试管中,加入BaCl2溶液,出现白色沉淀。
Ⅱ.确认其成分后,由于某些原因,此白色固体部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定变质固体中X的含量,具体步骤如下:
步骤Ⅰ 称取样品1.000 g。
步骤Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01 mol·L-1KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
(1)写出步骤Ⅲ所发生反应的离子方程式 。
(2)在配制0.01 mol·L-1KMnO4溶液时若仰视定容,则最终测得变质固体中X的含量 (填“偏大”“偏小”或“无影响”)。
(3)滴定结果如下表所示:
| 滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
则该变质固体中X的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于等离子体的叙述正确的是( )
A.物质一般有固态、液态和气态三态,等离子体被认为是物质存在的第四态
B.为了使气体变成等离子体,必须使其通电
C.等离子体通过电场时所有粒子的运动方向都发生改变
D.等离子体性质稳定,不易发生化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,动植物油脂与醇反应可制备生物柴油,化学方程式如下:
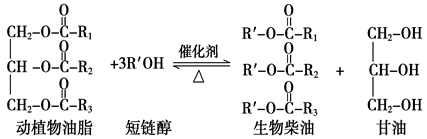
下列叙述错误的是
A.生物柴油由可再生资源制得
B.生物柴油是不同酯组成的混合物
C.动植物油脂是高分子化合物
D.“地沟油”可用于制备生物柴油
C。高分子化合物时分子量在10000以上的有机物,动植物油脂不是高分子化合物。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com