
【题目】如图表示A~E五种物质的相互转化关系,其中A为淡黄色粉末,C为单质。

(1)则A为_________。(填化学式)
(2)写出③、⑧对应的方程式:
③___________。(化学方程式)
⑧_________。(离子方程式)
【答案】Na2O2 2Na2O2+2CO2=2Na2CO3+O2 2Na+2H2O=2Na++2OH-+H2↑
【解析】
A为淡黄色粉末,能和CO2、H2O反应,则A是Na2O2,A和二氧化碳反应生成B,B是Na2CO3;A和水反应生成E,E能转化为B,则E是NaOH;C为单质,C能和水反应生成E,则C是Na,C和氯气反应生成氯化钠,B能转化为D,则D是NaCl,再结合物质之间的反应分析解答。
根据上述分析可知:A为Na2O2,B是Na2CO3;C是Na,D是NaCl, E是NaOH。
(1)通过以上分析知,A为过氧化钠,化学式为Na2O2;
(2)③为Na2O2和CO2的反应,反应方程式为2Na2O2+2CO2=2Na2CO3+O2;
⑧为Na和H2O的反应,生成NaOH和H2,其离子方程式为2Na+2H2O=2Na++2OH-+H2↑。


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案科目:高中化学 来源: 题型:
【题目】工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g),反应过程中的能量变化情况如图所示。
CH3OH(g),反应过程中的能量变化情况如图所示。

(1)曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。该反应是________(填“吸热”或“放热”)反应。计算当反应生成1.5 mol CH3OH(g)时,能量变化是________kJ。
(2)选择适宜的催化剂________(填“能”或“不能”)改变该反应的反应热。
(3)推测反应CH3OH(g)![]() CO(g)+2H2(g)是________(填“吸热”或“放热”)反应。
CO(g)+2H2(g)是________(填“吸热”或“放热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍能形成多种不同的化合物。图1是镍的一种配合物的结构,图2是一种镍的氧化物的晶胞。判断下列说法不正确的是( )
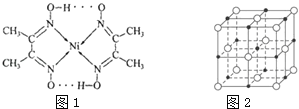
A.图2可能表示的是氧化镍(NiO)的晶胞
B.氧化镍中Ni2+、O2-的配位数都是6
C.镍原子位于元素周期表中第4周期ⅧB族,属于ds区元素
D.图1分子中存在的化学键有共价键、配位键、氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项正确的是
A. 钠与水反应的离子方程式:Na+H2O = Na++OH-+H2↑
B. 氯气与水反应的离子方程式:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
C. AlCl3溶液中滴入过量的氨水:Al3++3NH3·H2O = Al(OH)3↓+3NH4+
D. 钠和硫酸铜溶液反应的离子方程式:2Na+Cu2+ = 2Na++Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫是污染大气的主要物质之一。含二氧化硫的工业尾气可用如下方法来处理并制得有广泛用途的石膏。
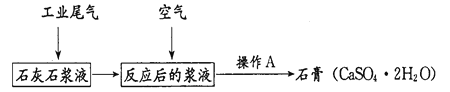
(1)SO2造成的一种常见环境污染为___;列举二氧化硫的一种用途___。
(2)SO2使紫色KMnO4溶液褪色的离子方程式为___;(提示:KMnO4 被还原为Mn2+)
(3)通空气时反应的化学方程式为___;若在实验室进行,操作A是_____。
(4)亚硫酸氢铵常用于造纸工业,若用某气体水溶液处理该工业尾气得到亚硫酸氢铵,则该气体为_______。
(5)有人提出在燃煤中加入适量的生石灰,可减少烟气中二氧化硫的排放,你认为是否合理?_______(填“合理”或“不合理”);理由是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 VSEPR 模型预测下列分子或离子的立体结构,其中正确的是( )
A.NH4+为正四面体形B.CS2为 V 形
C.HCN 为 V 形D.PCl3 为平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨法溶浸氧化锌烟灰制取高纯锌的工艺流程如图所示。溶浸后氧化锌烟灰中锌、铜、镉、砷元素分别以Zn(NH3)42+、Cu(NH3)42+、Cd(NH3)42+、AsCl52-的形式存在。
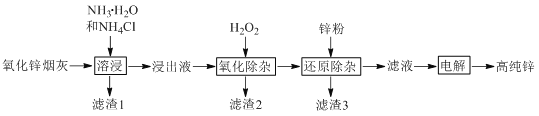
回答下列问题:
(1)Zn(NH3)42+中Zn的化合价为________,“溶浸”中ZnO发生反应的离子方程式为________。
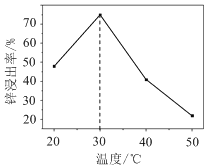
(2)锌浸出率与温度的关系如图所示,分析30 ℃时锌浸出率最高的原因为________。
(3)“氧化除杂”中,AsCl52-转化为As2O5胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式为________。
(4)“滤渣3”的主要成分为________。
(5)“电解”时Zn(NH3)42+在阴极放电的电极反应式为_______。阳极区放出一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是________(写化学式)。电解后的电解液经补充________(写一种物质的化学式)后可返回“溶浸”工序继续使用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏伽德罗常数的值,下列相关说法正确的是( )
A.2.24LN2和O2的混合气体中分子数为0.1NA
B.2.4g镁在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA
C.标准状况下,22.4LCCl4中含有分子的数目为NA
D.0.1molFeCl3完全水解生成的Fe(OH)3胶体粒子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用橄榄石尾矿(主要成分为MgO及少量FeO、Fe2O3、Al2O3等)制备纯净氯化镁晶体(MgCl2·6H2O),实验流程如下:
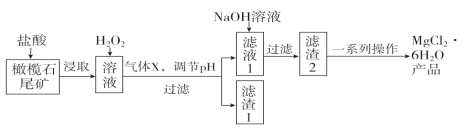
已知几种金属阳离子形成氢氧化物沉淀时的pH如下表:
Fe2+ | Fe3+ | Al3+ | Mg2+ | |
开始沉淀时 | 7.6 | 2.7 | 4.2 | 9.6 |
沉淀完全时 | 9.6 | 3.7 | 5.4 | 11.1 |
回答下列问题:
(1)“浸取”步骤中,能加快浸取速率的方法有____________、__________(任写两种)。
(2)气体X的电子式为________,滤渣1经过处理可以制得一种高效的无机高分子混凝剂、净水剂,其化学式为[Fe2(OH)n(SO4)(3-0.5n)]m,则该物质中铁元素的化合价为________。
(3)加入H2O2的目的是______________________;若将上述过程中的“H2O2”用“NaClO”代替也能达到同样目的,则发生反应的离子方程式为:________________________________。
(4)“一系列操作”主要包括加入足量盐酸,然后经过____________________、过滤、洗涤,即得到氯化镁晶体。
(5)准确称取2.000 g氯化镁晶体产品于250 mL锥形瓶中,加水50 mL使其完全溶解,加入100 mL氨性缓冲液和少量铬黑T指示剂,溶液显酒红色,在不断振荡下,用0.5000 mol/L的EDTA标准溶液进行滴定,其反应原理为Mg2++Y4- ==MgY2-,滴定终点时消耗EDTA标准溶液的体积19.00 mL。
①则产品中MgCl2·6H2O的质量分数为________(结果保留三位有效数字)。
②下列滴定操作会导致测量结果偏高的是________(填字母)。
a.滴定终点时仰视读数 b.锥形瓶洗涤后没有干燥
c.滴定时锥形瓶中有液体溅出 d.滴定管滴定前有气泡,滴定后气泡消失
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com