


科目:高中化学 来源: 题型:
| c(B) |
| c(C) |
查看答案和解析>>
科目:高中化学 来源: 题型:
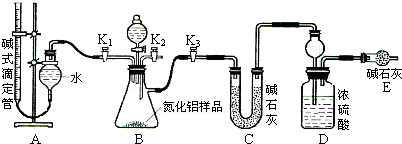
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(SO3)=0.4 mol?L-1 |
| B、c(SO2)=c(SO3)=0.15 mol?L-1 |
| C、c(SO2)=0.4mol?L-1 |
| D、c(SO2)+c(SO3)=0.4 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硫酸沾到皮肤上时,先用干净的布轻轻擦掉,再用大量水冲洗,最后涂上3%~5%的NaHCO3溶液 |
| B、配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 |
| C、酒精灯不慎碰倒起火时,可用湿抹布或沙子盖灭水扑灭,不能用水泼灭 |
| D、碱沾到皮肤上时,应立即用大量水冲洗,再涂上硼酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(Ⅰ)(Ⅱ)产物均相同 |
| B、(Ⅰ)(Ⅱ)产物均不同 |
| C、(Ⅰ)产物相同,(Ⅱ)产物不同 |
| D、(Ⅰ)产物不同,(Ⅱ)产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阳极反应:3O2+6e-+6H+=3H2O2 |
| B、氧化性:O2>O3 |
| C、电解一段时间后,溶液pH下降 |
| D、每转移3 mol电子,可生成标准状况下22.4 L O3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com