
| A. | 标准状况下,11.2L甲烷中含有的碳氢键数目为2NA | |
| B. | 常温下,1L0.1mol/L的Na2CO3溶液中含有OH-离子数为0.1NA | |
| C. | 常温常压下,28gN2、CO的混合气体中含有N2分子数为0.5NA | |
| D. | 标准状况下,22.4LCl2与足量NaOH溶液反应,转移的电子数为2NA |
分析 A.求出甲烷的物质的量,然后根据1mol甲烷中含4mol碳氢键来分析;
B.盐类水解为少量的、可逆的;
C.混合气体中氮气和CO的比例不确定;
D.氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,据此分析解答.
解答 解:A.标况下11.2L甲烷的物质的量为0.5mol,而1mol甲烷中含4mol碳氢键,故0.5mol甲烷中含碳氢键为2NA个,故A正确;
B.常温下,1L 0.1mol/L的Na2CO3溶液由于水解显碱性,但水解程度很小故碱性较弱,即溶液中的氢氧根的浓度小于0.1mol/L,则在1L溶液中,氢氧根的个数小于0.1NA个,故B错误;
C.混合气体中氮气和CO的比例不确定,无法计算氮气的物质的量和分子数,故C错误;
D.标况下22.4L氯气的物质的量为1mol,而氯气和碱的反应为歧化反应,故1mol氯气和碱反应转移NA个电子,故D错误;
故选:A.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,注意盐类水解规律、甲烷结构特点.


科目:高中化学 来源: 题型:选择题
| A. | SiH4的空间构型是正四面体 | |
| B. | 在NH4+和[Cu(NH3)4]2+中都存在配位键 | |
| C. | 原子晶体中原子以共价键结合,具有键能大、硬度大的特性 | |
| D. | SO2、SO3都是极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤⑥ | B. | ①②④⑤ | C. | ③④⑤⑥ | D. | ①②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
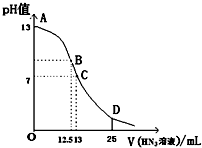 纯的叠氮酸(HN3)是无色液体,常用做引爆剂,常温下向25mL 0.1mol•L-1NaOH溶液中加入0.2mol•L-1HN3的溶液,滴加过程中的pH值的变化曲线(溶液混合时的体积变化忽略不计)如图.下列说法正确的是( )
纯的叠氮酸(HN3)是无色液体,常用做引爆剂,常温下向25mL 0.1mol•L-1NaOH溶液中加入0.2mol•L-1HN3的溶液,滴加过程中的pH值的变化曲线(溶液混合时的体积变化忽略不计)如图.下列说法正确的是( )| A. | 若用已知浓度的NaOH溶液滴定HN3溶液来测定HN3的浓度时应用甲基橙作指示剂 | |
| B. | 常温下,向0.2mol•L-1HN3的溶液中加水稀释,则 $\frac{c({{N}_{3}}^{-})}{c(O{H}^{-})•c(H{N}_{3})}$不变 | |
| C. | 分别中和PH均为4的HN3溶液和HCl溶液,消耗0.1mol•L-1NaOH溶液的体积相同 | |
| D. | D点时溶液中离子浓度存在如下关系:c(H+)+c(HN3)=c(N3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 |
| A | 在氧气中点燃Mg条 | 发出耀眼白光,生成白色固体 |
| B | 将乙烯通入酸性高锰酸钾溶液 | 溶液褪色 |
| C | 将点燃的Na块伸入Cl2瓶中 | Na块剧烈燃烧,生成大量黑烟 |
| D | 将碘水滴到新切的土豆片上 | 土豆片表面变蓝 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol•L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
| c(S2O82-)/mol•L-1 | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
| t/s | 88.0 | 44.0 | 22.0 | 44.0 | t1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅤⅠA | ⅤⅡA | O |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 四 | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com