
| A. | 平衡向正反应方向移动了 | B. | A的转化率变大了 | ||
| C. | a<c+d | D. | △H值变大了 |
分析 假定平衡不移动,将气体体积压缩到原来的一半,C的浓度为原来的2倍,实际再次达到新平衡时,C的浓度为原来的1.7倍,说明压强增大,平衡向逆反应移动,即a<c+d,压强增大,速率加快,新平衡的正、逆速率都大于原平衡,据此结合选项解答.
解答 解:A、平衡向逆反应方向移动,故A错误;
B、平衡向逆反应方向移动,A的转化率减少,故B错误;
C、压强增大,平衡向逆反应移动,即a<c+d,故C正确;
D、反应热只与反应物和生成物的总能量有关,所以△H的值不变,故D错误;
故选C.
点评 本题可以化学平衡的影响因素,难度不大,根据D的浓度变化判断平衡移动方向是解题的关键,注意根据平衡移动图象理解速率的变化.


科目:高中化学 来源: 题型:解答题
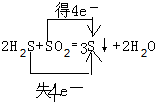 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z |
| 初始浓度/(mol•L-1) | 0.1 | 0.2 | 0 |
| 平衡浓度/(mol•L-1) | 0.05 | 0.05 | 0.1 |
| A. | 反应达到平衡时,X的转化率为50% | |
| B. | 该反应的化学方程式为3X(g)+Y(g)?2Z(g) | |
| C. | 25℃时,该反应的平衡常数为1600 | |
| D. | 改变温度可以改变此反应的平衡常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是物质的数量单位 | |
| B. | 58.5 gNaCl溶解在1 L水中,得到溶液的物质的量浓度为1mol/L | |
| C. | 标况下,1 mol CCl4 所占的体积约为22.4 L | |
| D. | 12g12C含有的碳原子数约为6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A. | 4s时c(B)为0.76mol/L | |
| B. | 830℃达平衡时,A的转化率为80% | |
| C. | 反应达平衡后,升高温度,平衡正向移动 | |
| D. | 1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | ||||
| 晶体名称 | 碘化钾 | 干冰 | 氖 | 二氧化硅 |
| 组成晶体的微粒名称 | 阴、阳离子 | 分子 | 原子 | 原子 |
| 晶体内存在的结合力 | 离子键 | 范德华力 | 共价键 | 共价键 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com