
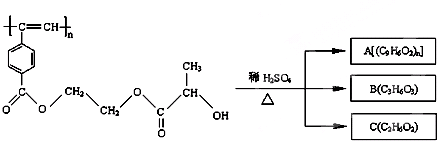
| A��M��A����ʹ���Ը��������Һ����ˮ��ɫ |
| B��B�к����Ȼ����ǻ����ֹ����ţ�B�ܷ�����ȥ��Ӧ��������Ӧ |
| C��1molM���ȵ��ռ���Һ��Ӧ��������2n mol��NaOH |
| D��A��B��C��1mol�ֱ�������Ʒ�Ӧ���ų�����������ʵ���֮��Ϊ1��2��2 |
 ��CΪOHCH2CH2OH��BΪ
��CΪOHCH2CH2OH��BΪ �����-COOH��-OH��C=C�����������
�����-COOH��-OH��C=C����������� ��CΪOHCH2CH2OH��BΪ
��CΪOHCH2CH2OH��BΪ ��
��

 ��ʦ������Ԫ��ĩ���100��ϵ�д�
��ʦ������Ԫ��ĩ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Mg2+��K+��SO42-��NO3- |
| B��Na+��OH-��NH4+��HCO3- |
| C��Al3+��K+��SO32-��ClO- |
| D��AlO2-��H+��Fe3+��Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������Ӧ��O2+2H2O+4e-�T4OH- |
| B������������Ӧ���Ǹ��� |
| C������������22.4LH2ʱ������11.2LO2���ģ���ͬ������ |
| D������ȼ�ϵ�ز�������ת���ʸߣ����Ҳ�����ˮ�����ڻ����Ѻõ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Ԫ�ش��� | L | M | Q | R | T |
| ԭ�Ӱ뾶/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| ��Ҫ���ϼ� | +2 | +3 | +2 | +6��+4��-2 | -2 |
| A����ϡ���ᷴӦ�ľ��ҳ̶ȣ�L���ʣ�Q���� |
| B�����ȶ��ԣ�H2T��H2R |
| C���е㣺H2T��H2R |
| D��L2+��R2-����������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���� | B��īˮ |
| C��ʯ���� | D��KCl��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����λ�����ڱ��ĵ������ڡ��ڢ�A�� |
| B�����ơ��ء�����ֵ����У�卑��۵���� |
| C�����������ǿ�� |
| D������������ӻ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
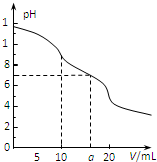 �����£��� 0.1mol?L-1 HCl��Һ�ζ�10.0mLŨ��Ϊ0.1mol?L-1 Na2CO3��Һ�����õζ�������ͼ��ʾ������˵������ȷ���ǣ�������
�����£��� 0.1mol?L-1 HCl��Һ�ζ�10.0mLŨ��Ϊ0.1mol?L-1 Na2CO3��Һ�����õζ�������ͼ��ʾ������˵������ȷ���ǣ�������| A����V=0ʱ��c��H+��+c��HCO3-��+2c��H2CO3��=c��OH-�� |
| B����V=5ʱ��c��CO32-��+c��HCO3-��+c��H2CO3��=2c��Cl-�� |
| C����V=10ʱ��c��Na+����c��HCO3-����c��CO32-����c��H2CO3�� |
| D����V=aʱ��c��Na+����c��Cl-����c��H+��=c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���÷�Ӧ�ﵽƽ��ʱ���ų�����������92.4kJ |
| B���ﵽƽ�����������ͨ��1mol������ƽ�������ƶ� |
| C�����ﵽƽ��ʱN2��ת����Ϊ20%����ƽ��ʱ�����ڵ�ѹǿ����ʼʱ��80% |
| D�����ﵽƽ��ʱN2��ת����Ϊ20%����ƽ��ʱ�����ڵ�ѹǿ����ʼʱ��90% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ۢݢ� | B���ۢܢ� |
| C���٢ڢ� | D���ۢܢ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com