
| A. | 常温下干燥氯气与铁不反应,可以用钢瓶储存氯水 | |
| B. | 浓硫酸、浓硝酸都具有强氧化性,不能盛放在金属容器中 | |
| C. | 石英玻璃耐强酸强碱,高温下可用来熔融氢氧化钠 | |
| D. | Na2SiO3是制备硅胶和木材防火剂的原料 |
分析 A.氯水不能用钢瓶储存;
B.依据浓硫酸能够使铁铝钝化解答;
C.二氧化硅能够与氢氧化钠反应;
D.硅酸钠具有粘性、不易燃烧.
解答 解:A.干燥的氯气与铁在常温下不反应,但氯水中含有盐酸,可与铁反应,所以氯水不能用钢瓶储存,故A错误;
B.浓硫酸、浓硝酸都具有强氧化性,常温下能够使铁铝钝化,形成致密氧化膜,组织反应进行,所以可以用铝、铁盛放浓硫酸、浓硝酸,故B错误;
C.二氧化硅能够与氢氧化钠反应,高温下不可用来熔融氢氧化钠,故C错误;
D.硅酸钠具有粘性、不易燃烧,制备硅胶和木材防火剂的原料,故D正确;
故选:D.
点评 本题考查了物质的用途,性质决定用途,明确相关物质的性质是解题关键,侧重考查学生对基础知识的掌握.


科目:高中化学 来源: 题型:解答题
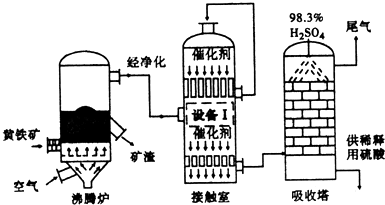
| 截面位置 含量 过程气体流 | 1(接触室人口处) | 2 | 3 | 4 |
| O2物质的量的百分含量 | 11.0% | 10.10% | 8.48% | 8.48% |
| SO2物质的量的百分含量 | 6.00% | 4.04% | 0.51% | 0.51% |
| SO3物质的量的百分含量 | 1.00% | 3.03% | 6.68% | 6.68% |
| N2物质的量的百分含量 | 81.00% | 81.83% | 83.31% | 83.31% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
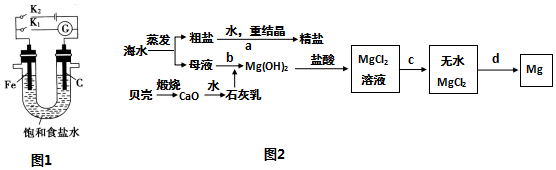
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
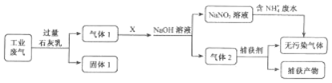
| 离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
| c(mol•L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
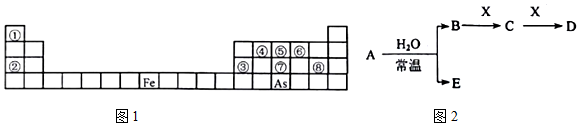
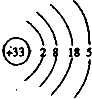 ;其氢化物的化学式为AsH3.
;其氢化物的化学式为AsH3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com