
现有以下物质:①NaHCO3晶体②液态SO3③HF④盐酸⑤蔗糖⑥铜⑦KOH固体⑧氨水。请回答下列问题;
(1)属于非电解质的是________________,
(2)属于电解质的_______________,
(3)属于电解质的依次写出其在水中的电离方程式:______________
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
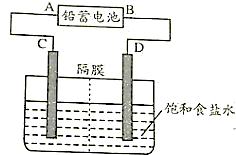
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上第三次月考化学卷(解析版) 题型:填空题
(本题满分18分)二甲 醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
编号 | 热化学方程式 | 化学平衡常数 |
① | CO(g)+2H2(g) | K1 |
② | 2CH3OH(g) | K2 |
③ | CO(g)+H2O(g) | K3 |
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H﹣H | C﹣O | C=O | H﹣O | C﹣H |
E/(kJ.mol﹣1) | 436 | 343 | 1076 | 465 | 413 |
由上述数据计算△H1= ;
(2)该工艺的总反应为3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)△H,该反应△H= ,化学平衡常数K= (用含K1、K2、K3的代数式表示);
CH3OCH3(g)+CO2(g)△H,该反应△H= ,化学平衡常数K= (用含K1、K2、K3的代数式表示);
(3)下列措施中,能提高CH3OCH3产率的有 ;
A.分离出二甲醚 B.升高温度
C.改用高效催化剂 D.增大压强
(4)工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生.该工艺中反应③的发生提高了CH3OCH3的产率,原因是 ;
(5)以n(H2)/n(CO)=2 通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是 ;
CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是 ;
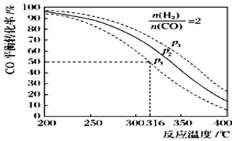
A.该反应的△H>0
B.若在p2和316℃时反应达到平衡,则CO的转化率小于50%
C.若在p3和316℃时反应达到平衡,H2的转化率等于50%
D.若在p3和316℃时,起始时n(H2)/n(CO)=3,则达平衡时CO的转化率大于50%
E.若在p1和200℃时,反应达平衡后保持温度和压强不变,再充入2mol H2和1mol CO,则平衡时二甲醚的体积分数增大
(6)某温度下,将8.0mol H2和4.0mol CO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g),反应达平衡后测得二甲醚的体积分数为25%,则该温度下反应的平衡常数K= .
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:填空题
某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。请回答下列问题: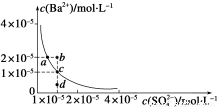
(1)下列说法正确的是__________(填字母序号)。
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
(2)将100 mL 1 mol·L-1 H2SO4加入100 mL含Ba2+ 0.137 g 的溶液中充分反应后,过滤出沉淀,滤液中残留的Ba2+的物质的量浓度为____________(保留三位有效数字)。
(3)将沉淀用100 mL纯水或100 mL 0.01 mol·L-1的H2SO4分别洗涤,两种情况下损失的BaSO4的质量之比为_____________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:选择题
下表是25℃时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是( )
化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
Ksp或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
A.相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是
c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.碳酸钠溶液中滴加少量氯水的离子方程式H2O+2CO32-+Cl2=2HCO3-+Cl-+ClO-
C.向0.1mol/LCH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=9:5,此时溶液pH=5
D.向浓度均为1×10-3mol/L的KCl和K2CrO4混合液中滴加1×10-3mol/L的AgNO3溶液,CrO42-先形成沉淀
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:选择题
下列每组物 质中含有的化学键类型相同的是( )
质中含有的化学键类型相同的是( )
A.NaCl、HCl、H2O、NaOH B.Cl2、Na2S、HCl、SO2
C.HBr、CO2 、H2O、CS2 D.Na2O2、H2O2、H2O、O3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
用铅蓄电池电解AgNO3、Na2SO3的溶液,a、b、c、d电极材料均为石墨,已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(1)通电时a电极质量增加,下列说法正确的是
2PbSO4(s)+2H2O(1)通电时a电极质量增加,下列说法正确的是

A.电路中通过1mol电子时,Y电极质量增加48g
B.放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO42-(aq)+2e-===PbSO4(s)+2H2O(l)
C.c、d电极产生气体的物质的量之比为1∶2
D.X极为负 极
极
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NO2(g)?N2O4(g)(正反应为放热反应) | |
| B. | 2SO3(g)?2SO2(g)+O2(g)(正反应为吸热反应) | |
| C. | H2(g)+I2(g)?2HI (g)(正反应为放热反应) | |
| D. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g) (正反应为放热反应) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com