
【题目】在环保、化工行业有一种溶液浓度的表示方法:质量—体积浓度,用单位体积溶液中所含的溶质质量来表示,单位g·m-3或g·L-1。现有一种20 ℃时的饱和CuSO4溶液,密度为1.2 g·cm-3,质量—体积浓度为200 g·L-1,则对此溶液的说法不正确的是( )
A. 该溶液的质量分数为16.7%
B. 该溶液的物质的量浓度为1.25 mol·L-1
C. 在20 ℃时,硫酸铜的溶解度为20 g
D. 在20 ℃时把200 g CuSO4·5H2O溶解于1 L水中恰好得到饱和溶液
科目:高中化学 来源: 题型:
【题目】已知:pAg=-lg{c(Ag+)},Ksp(AgCl)=1.56×10-10。如图是向10 mL AgNO3溶液中逐渐加入0.1 mol·L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图像(实线)。根据图像所得下列结论正确的是[提示:Ksp(AgCl)>Ksp(AgI)]

A. 原AgNO3溶液的物质的量浓度为0.1 mol·L-1
B. 图中x点的坐标为(100,6)
C. 图中x点表示溶液中Ag+恰好完全沉淀
D. 把0.1 mol·L-1的NaCl换成0.1 mol·L-1NaI则图像在终点后变为虚线部分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某药物H的合成路线如下:

试回答下列问题:
(1)反应Ⅰ所涉及的物质均为烃,氢的质量分数均相同。则A分子中最多有______个原子在同一平面上,最多有______个碳原子在同一条直线上。
(2)反应Ⅰ的反应类型是______反应Ⅱ的反应类型是______,反应Ⅲ的反应类型是______。
(3)B的结构简式是______;E的分子式为______;F中含氧官能团的名称是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种从废甲醇催化剂(含ZnO、CuO及少量Fe2O3、石墨及MnO2等)回收铜并制取活性氧化锌的工艺流程如下:

回答下列问题:
(1)废催化剂“破碎”的目的是________,“酸浸”后“浸渣”的主要成分是________。
(2)“氧化”时Mn2+被氧化的离子方程式为________。
(3)“中和沉淀”时pH对锌转化为碱式碳酸锌的转化率影响如图所示:pH>7时,转化率开始减小的原因是________[用离子方程式说明,已知Zn(OH)2性质与Al(OH)3类似]。
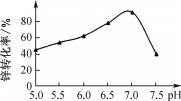
(4)“过滤3、洗涤”时,能证明已洗涤干净的操作方法是________;所得滤液中主要溶质是________。
(5)测定“粗铜粉”中铜的质量分数的实验步骤如下:
Ⅰ.准确称取粗铜粉mg,加入足量HCl和H2O2使其完全溶解(Cu+H2O2+2H+=Cu2++2H2O,Zn及Fe也同时溶解)。
Ⅱ.将溶液煮沸1~2min,除去过量的H2O2。
Ⅲ.依次滴入适量氨水、醋酸及NH4HF2溶液,以排除Fe3+的干扰。然后加入稍过量的KI(2Cu2++4I-=2CuI↓+I2),再加入1mL淀粉溶液作指示剂,用cmol·L-1Na2S2O3标准溶液滴定至蓝色消失(I2+2S2O32-=2I-+S4O62-)且半分钟内不变色,共消耗Na2S2O3标准溶液VmL。
①铜的质量分数为________(列出计算表达式)。
②缺少步骤Ⅱ会使测定的铜的质量分数________(填“偏大”“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:

(1)表中化学性质最不活泼的元素,其原子结构示意图为______。
(2)元素⑦与⑧的原子半径大小关系是:⑦______⑧(填“>”或“<”)。
(3)④⑤两元素相比较,金属性较强的是______ (填元素名称)。
(4)元素①的最高价氧化物的水化物的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌空气燃料电池可用作电动车电源,电解质溶液为KOH溶液,正向放电,逆向充电,总反应为:Zn+O2+4OH-+2H2O ![]() 2Zn(OH)42-,下列说法正确的是
2Zn(OH)42-,下列说法正确的是
A. 充电时,电解质溶液中K+向阳极移动
B. 充电时,电解质溶液中c(OH-)逐渐减小
C. 放电时,负极反应为:Zn+4OH--2e-===Zn(OH) 42-
D. 可用盐酸代替KOH作电解液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法与盐类水解有关且正确的是: ( )
A. AlCl3溶液和NaAlO2溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同
B. 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度
C. 用加热的方法可除去KCl溶液中混有的Fe3+
D. 食醋可以溶解水垢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在373K时,把0.5mol N2O4气体通入体积为5L的恒容密闭容器中,立即出现红棕色。反应进行到2秒时,NO2的浓度为0.02 mol/L。在60秒时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是( )
A. 前2秒,以N2O4的浓度变化表示的平均反应速率为0.01mol/(L·s)
B. 在2秒时体系内的压强为开始时的1.2倍
C. 在平衡时体系内含N2O40.20mol
D. 平衡时,如果再充入一定量N2O4, 则可提高N2O4的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)在0.4 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题。

(1)该混合液中,NaCl的物质的量为______mol,含溶质MgCl2的质量为________g。
(2)该混合液中CaCl2的物质的量为________mol,将该混合液加水稀释至体积为1 L,稀释后溶液中Ca2+的物质的量浓度为________mol·L1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com