
氢气是清洁的能源,也是重要的化工原料。
(1)以H2为原料制取氨气进而合成CO(NH2)2的反应如下:
N2(g)+3H2(g)=2NH3(g) △H=—92.40 kJ·mol-1
2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=—159.47 kJ·mol-1
NH2CO2NH4(s)=CO(NH2)2(s)+H2O (l) △H=+72.49 kJ·mol-1
则N2(g)、H2(g)与CO2(g)反应生成CO(NH2)2(s)和H2O(l)的热化学方程式为 ▲ 。
(2)用丙烷和水为原料在电催化下制氢气,同时得到一种含有三元环的环氧化合物A,该反应的化学方程式为 ▲ 。
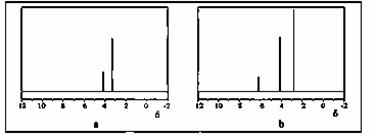
该反应也可生成A的同分异构体——另一种环氧化合物B,B的核磁共振氢谱为
下图中的 ▲ (填“a”或“b”)。
(3)已知叠氮酸(HN3)不稳定,同时也能与活泼金属反应,反应方程式为:
2HN3=3N2↑+H2↑
2HN3+Zn=Zn(N3)2+H2↑
2 mol HN3与一定量Zn完全反应,在标准状况下生成67.2 L气体,其中N2的物质的量为 ▲ 。
(4)已知H2S高温热分解制H2的反应为:
H2S(g) H2(g)+1/2S2(g)
H2(g)+1/2S2(g)
在恒容密闭容器中,控制不同温度进行H2S的分解实验:
 以H2S的起始浓度均为c mol·L-1测定H2S的转化率,结果如右下图所示。图中
以H2S的起始浓度均为c mol·L-1测定H2S的转化率,结果如右下图所示。图中
a为H2S的平衡转化率与温度关系
曲线,b曲线表示不同温度下反应
经过相同时间且未达到化学平衡时
H2S的转化率。
若985℃时,反应经t min达到平衡,
此时H2S的转化率为40%,则反应
速率v(H2)= ▲ (用含c、t的代
数式表示)。
 请说明随温度的升高,曲线b向曲线a逼近的原因: ▲ 。
请说明随温度的升高,曲线b向曲线a逼近的原因: ▲ 。
(5)用惰性电极电解煤浆液的方法制H2的反应为:
C(s)+2H2O(l)=CO2(g)+2H2(g)
现将一定量的1 mol·L-1 H2SO4溶液和适量煤
粉充分混合,制成含碳量为0.02 g·mL-1~0.12
g·mL-1的煤浆液,置于右图所示装置中进行电
解(两电极均为惰性电极)。则A极的电极
反应式为 ▲ 。
科目:高中化学 来源: 题型:
下列说法不正确的是
A.乙醇和浓硫酸反应制乙烯时,利用NaOH溶液可除去杂质气体
B.向饱和Na2CO3溶液中通入足量CO2,可析出NaHCO3,使溶液变浑浊。
C.室温下向苯和少量苯酚的混合溶液中加入适量NaOH溶液,振荡、静置后分液,可除去苯中少量苯酚
D.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是
A.氯气溶于水:Cl2+H2O H++Cl-+HClO
H++Cl-+HClO
B.铝溶于氢氧化钠溶液:Al+2OH-+H2O=AlO2-+2H2↑
C.少量的CO2 通入氨水中:CO2+NH3·H2O=NH4++HCO3-
D.用醋酸溶液除去水垢:2H++CaCO3=Ca2++CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下进行反应:COCl2(g) Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入
Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入
1.0 mol COCl2(g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列说法正确的是
A.保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol·L-1,则反应的ΔH<0
B.若在2 L恒容绝热(与外界没有热量交换)密闭容器进行该反应,化学平衡常数不变
C.保持其他条件不变,起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO,
反应达到平衡前的速率:v(正)<v(逆)
D.保持其他条件不变,起始向容器中充入1.0 molCl2和0.8 molCO,达到平衡时,
Cl2的转化率小于60%
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组反应,实质都是取代反应的是( )
A.苯硝化,苯酚和溴水反应,皂化反应,乙烯与溴水反应
B.酯的水解,酯化反应,乙醇和氢卤酸反应,乙醇和浓硫酸加热至140℃时的反应
C.淀粉在硫酸存在下制葡萄糖,醛的氧化或还原
D.纤维素水解,浓硫酸和乙醇在170℃时的反应,蛋白质水解
查看答案和解析>>
科目:高中化学 来源: 题型:
分类法是学习化学的重要方法,人们在认识事物时可采用多种分类方法。下表各组归类
| 序号 | 分类标准 | 归类 |
| A | FeSO4、NO2、MnO2、NaClO、Cu3P、Na2O2 | H2SO3 |
| B | CH3COOH、HOOC—COOH、HClO、H2S | HF |
| C | 复分解反应、电解反应、放热反应、离子反应 | 焰色反应 |
| D | (NH4)2SO4、NH4Cl、NH4NO3、NH3·H2O | NH4HCO3 |
(1)A中分类标准是______________________________________________,H2SO3________(填“是”或“否”)可归为此类。
(2)B中分类标准是_________________________________________________,HF________(填“是”或“否”)可归为此类。
(3)C中分类标准是__________________,焰色反应属于________变化。
(4)D中分类标准是__________________,NH4HCO3________(填“是”或“否”)可归为此类。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学平衡常数K的说法中正确的是
A.平衡常数的大小与起始浓度有关 B.K值越大,反应的转化率越小
C.K值越大,反应的转化率越大 D.温度越高,K值越大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com