
【题目】硫是生物必需的大量营养元素之一,下图是自然界中硫的循环图,请分析此图并回答有关问题。

(1)氮循环和硫循环是自然界中两种重要的元素循环过程,下列关于这两种循环的说法正确的是________。
选项 | 比较 | 氮循环 | 硫循环 |
A | 异 | 氮元素会进入大气 | 硫元素不会进入大气 |
B | 氮循环过程有生物圈参与 | 硫循环过程无生物圈参与 | |
C | 同 | 人类活动对氮循环和硫循环都造成巨大影响 | |
D | 氮循环和硫循环对环境的影响是都能导致温室效应 | ||
(2)分解者可将含硫有机物分解为H2S,硫磺细菌和硫化细菌可将H2S进一步变为硫单质或硫酸盐,下列关于硫化氢说法正确的是_______。
A.H2S分子很稳定,受热难分解
B. H2S分子中所有原子的最外层都达到8电子结构
C.将H2S通入FeSO4溶液,产生沉淀
D.H2S中硫元素为-2价,因此H2S只有还原性,没有氧化性
E.H2S是一种无色臭鸡蛋气味的有毒气体
(3)大气中的SO2经过一系列转化最终生成H2SO4,导致降水具有较强酸性,称为酸雨。检验某次降雨是否为酸雨的方法是_________________,收集某次酸雨样品,发现8小时内,样品pH一直在减小,其原因可能是________________。(用化学方程式表示)
(4)为了防治酸雨,工业上常采用“钙基固硫法”即将生石灰和含硫的煤混合后燃烧,燃烧时硫、氧气和生石灰共同作用,使硫元素转移到炉渣中,大部分硫元素最终转化为固体盐是_______(填化学式)。
【答案】C E 测pH 2H2SO3+O2=2H2SO4 CaSO4
【解析】
(1)根据自然界中N、S的循环图分析判断;
(2)根据H2S的组成元素的结合方式、元素的化合价等分析;
(3)根据酸雨的定义分析判断方法;
(4)S燃烧产生SO2与CaO反应产生CaSO3,CaSO3在被氧化为CaSO4。
(1)根据自然界中N、S的循环图可知:氮、硫元素都会进入大气,A错误;
B.氮、硫循环过程均有生物圈参与,B错误;
C.人类活动对氮循环和硫循环都造成巨大影响,C正确;
D.氮循环和硫循环对环境的影响是都能导致酸雨的形成,D错误;
故合理选项是C;
(2) A.H2S分子中S-H键能小,容易断裂,因此H2S不稳定,受热易分解,A错误;
B.H2S分子中S原子的最外层都达到8电子结构,H原子达到最外层2个电子的稳定结构,B错误;
C.由于酸性H2SO4>H2S,所以将H2S通入FeSO4溶液,不发生反应,无沉淀产生,C错误;
D.H2S中硫元素为-2价,因此H2S具有还原性,其中的H元素化合价为+1,因此也具有氧化性,D错误;
E.H2S是一种无色臭鸡蛋气味的有毒气体,E正确;
故合理选项是E;
(3)酸雨是pH<5.6的酸性降水,所以要测定某次降雨是否为酸雨的方法是使用pH测溶液的pH;
(4)煤中含有的S元素在燃烧产生SO2气体,SO2是酸性氧化物,与碱性氧化物CaO在高温下化合反应产生CaSO3,CaSO3具有还原性,被O2氧化为CaSO4,所以使硫元素转移到炉渣中,大部分硫元素最终转化为固体盐是CaSO4。


科目:高中化学 来源: 题型:
【题目】为了研究化学反应A+B===C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:

(1)该反应为____________(填“放热”或“吸热”)反应。
(2)A和B的总能量比C和D的总能量____________(填“高”或“低”)。
(3)物质中的化学能通过________转化成________释放出来。
(4)反应物化学键断裂吸收的能量________(填“高”或“低”)于生成物化学键形成放出的能量。
(5)写出一个符合题中条件的化学方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素是生命的基础,自然界中氮的循环过程如下图所示,请分析此图并回答有关问题。

(1)大气中的氮以________(填化学式)形式存在,图中共表示了_______种固氮的途径。
(2)由图可知,动植物体内的氮主要存在于蛋白质中,当动植物尸体发生腐败时,往往会产生一种含氮的气体,其电子式为________。
(3)土壤中的硝酸盐会被细菌分解。有一种脱氧硫杆菌能够利用土壤中的硫化物来分解硝酸盐,其主要化学原理如下:K2S+KNO3+H2O![]() N2↑+K2SO4+KOH,配平上述反应方程式,并标出电子转移的方向和数目___________。上述反应的氧化剂是_____,被氧化的元素是______。
N2↑+K2SO4+KOH,配平上述反应方程式,并标出电子转移的方向和数目___________。上述反应的氧化剂是_____,被氧化的元素是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程中CO2体积变化记录如图所示(CO2的体积已折算为保准状况下的体积),回答下列问题:
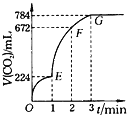
①0~3min中,_______段(选择OE、EF、FG)表示的平均反应速率最大,OE、EF、FG三段中,该反应用CO2表示的平均反应速率之比为______。
②用盐酸表示EF段中该反应的平均反应速率为________mol/(Lmin)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2气体是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒.
(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,在这个过程中,Fe2+、Mn2+的化合价升高,说明ClO2具有______性.
(2)工业上可以通过下列方法制取ClO2,请完成该化学反应方程式:2KClO3+SO2==2ClO2+_____。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,写出化学方程式:_____________
(4)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8mg/L之间。碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ加入一定量的Na2S2O3溶液。(已知:2S2O32-+I2== S4O62-+2I-)
Ⅲ加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如图所示:

请回答:
①操作Ⅰ中反应的离子方程式是_____。
②在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是_____。
③若水样的体积为1.0L,在操作Ⅱ时消耗了1.0×10-3mol/L的Na2S2O3溶液10ml,则水样中ClO2的浓度是_____ mg/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告提出将我国建设成为制造强国,2020年我国“PX”产能将达到3496万吨/年。有机物(烃)“PX”的结构模型如下图,下列说法错误的是

A. “PX”的二氯代物共有6种(不考虑立体异构) B. “PX”的分子式为C8H10
C. “PX”分子中,最多有14个原子共面 D. 可用酸性KMnO4溶液鉴别“PX”与苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学与自然资源的开发利用说法中不正确的是( )
A. 海水提溴是将海水中的化合态的溴富集再转化为游离态的溴
B. 石油裂化的主要目的是提高汽油的产量
C. 煤干馏的产品很多,是一个化学変化
D. 海水提镁的过程为:MgCl2(aq)![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com