
| A. | M+2Q | B. | M+4Q | C. | 2Q | D. | 2M+2Q |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
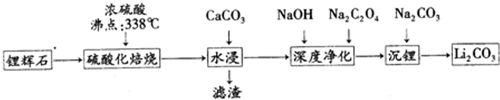
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 云母是热的不良导体.传热不均匀 | |
| B. | 石蜡是热的不良导体.传热不均匀 | |
| C. | 石蜡具有各向异性,不同的方向导热性不同 | |
| D. | 云母具有各向异性,不同的方向导热性不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min 浓度 物质 | 0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2mol•L-1 | 0.13mol•L-1 | 0.1mol•L-1 | 0.1mol•L-1 | 0.09mol•L-1 |
| H2 | 0mol•L-1 | 0.2mol•L-1 | 0.3mol•L-1 | 0.3mol•L-1 | 0.33mol•L-1 |
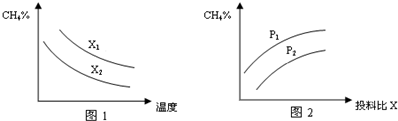
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 碳酸氢钙溶液与盐酸反应:HCO3-+H+═H2O+CO2↑ | |
| C. | 醋酸跟氢氧化钾溶液反应:CH3COOH+OH-═CH3COO-+H2O | |
| D. | 碳酸镁跟稀硫酸反应:MgCO3+2H+═Mg2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>b | B. | a=b | C. | a<b | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向久置的氯水中滴入紫色石蕊试液,溶液将先变红后褪色 | |
| B. | 欲除去Cl2中少量HCl气体,可将此混合气体通过盛饱和食盐水的洗气瓶 | |
| C. | 漂白粉有效成分是CaCl2和Ca(ClO)2,应密闭保存 | |
| D. | Cl2与水反应生成盐酸和次氯酸的离子方程式为:Cl2+H2O═2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向溴的煤油溶液里加入苯震荡 | B. | 向溴水里加入酒精后震荡 | ||
| C. | 向碘的四氯化碳的溶液里加水震荡 | D. | 向碘水里加入四氯化碳后震荡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com