
铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。

 (1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:
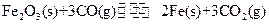
 ①该反应的平衡常数表达式为:K=
①该反应的平衡常数表达式为:K=  ②该温度下,在2L盛有
②该温度下,在2L盛有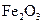 粉末的密闭容器中通入CO气体,10min后,生成了单
粉末的密闭容器中通入CO气体,10min后,生成了单 质铁11.2g。则10min内CO的平均反应速率为
质铁11.2g。则10min内CO的平均反应速率为  (2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态: ① ②
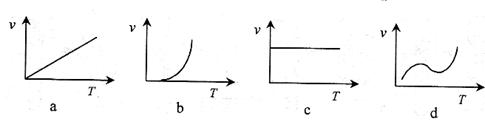
① ②  (3)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)
(3)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v) 和温度(T)的关系示意图中与铝热反应最接近的是 。
和温度(T)的关系示意图中与铝热反应最接近的是 。
 (4)写出氢氧化铝在水中发生酸式电离的电离方程式:
(4)写出氢氧化铝在水中发生酸式电离的电离方程式:  欲使上述体系中
欲使上述体系中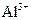 浓度增加,可加入的物质是 。
浓度增加,可加入的物质是 。
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:阅读理解
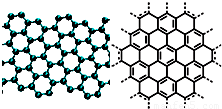
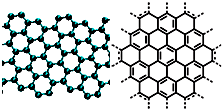 A.美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用方面的突破.石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性.制备石墨烯方法有石墨剥离法、化学气相沉积法等.石墨烯的球棍模型及分子结构示意图如右:
A.美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用方面的突破.石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性.制备石墨烯方法有石墨剥离法、化学气相沉积法等.石墨烯的球棍模型及分子结构示意图如右:
查看答案和解析>>
科目:高中化学 来源: 题型:



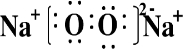
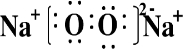
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2011年高考化学总复习30分钟限时训练:专题16 铁铜及其化合物 题型:022
有七种金属:钠、铝、铁、锡、铜、银、金,它们的标号分别为A、B、C、D、E、F、G.
①常温下,只有A和水反应生成氢气;
②D、E、G都能和稀硫酸反应生成氢气;
③D、E、G中只有D与NaOH溶液反应;
④B、F组成原电池时,F为正极;
⑤将G、E组成的合金暴露在潮湿的空气中,经一段时间后,合金的表面有G的化合物出现;
⑥用石墨电极电解含有相同物质的量浓度的B和C两种金属的硝酸盐溶液,B的单质先析出.回答下列问题:
(1)B的元素符号是________;G元素在元素周期表中的位置是________.
(2)D的最高价氧化物与A的最高价氧化物对应水化物发生反应的离子方程式为________.D的单质与G的最高价氧化物发生反应的化学方程式为________,该反应在生产中有重要应用,被称为________反应.
(3)写出⑥中的电极反应式:阳极:________,阴极________.
(4)将C的氯化物溶液蒸干灼烧得到的固体物质是________,原因是________(用必要的文字和离子方程式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2009-2010学年江苏省盐城市高三(上)期中化学试卷(解析版) 题型:解答题


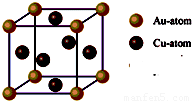
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com