
单斜硫和正交硫转化为二氧化硫的能量变化如右图所示,下列说法正确的是
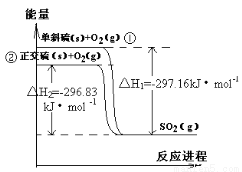
A.S(s,单斜) = S(s,正交) △H = +0.33kJ/mol
B.正交硫比单斜硫稳定
C.相同物质的量的正交硫比单斜硫所含有的能量高
D.1molSO2(g)分解成lmol S(s,单斜)和lmol O2(g)时会放出热量
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源:2016届甘肃省高三12月月考化学试卷(解析版) 题型:填空题
根据信息作答:
(1)在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵。
①写出上述制备小苏打的化学方程式:__________________________________。
②滤出小苏打后,母液提取氯化铵有两种方法:Ⅰ.通入氨,冷却、加食盐,过滤;Ⅱ.不通氨,冷却、加食盐,过滤。其中方法Ⅰ析出的氯化铵的纯度更高,其原因是___________。而方法Ⅱ的优点是其滤液可以_______________。
(2)铅及其化合物可用于蓄电池,耐酸设备及X射线防护材料等。PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为_____________________:PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的电极反应式_________________,电解液中加入Cu(NO3)2的原因是___________________。
查看答案和解析>>
科目:高中化学 来源:2016届内蒙古包头第九中学高三上期中考试理综化学试卷(解析版) 题型:实验题
二氧化硫为无色气体,有强烈刺激性气味,是大气主要污染物之一。某化学兴趣小组欲制备并探究SO2的某些性质。
【SO2的制备】用亚硫酸钠与较浓的硫酸反应制备SO2的装置图如下(夹持仪器省略):

(1)图中的装置错误的是 ;B中发生反应的化学方程式为 ;D的作用是 。
【SO2的性质】探究SO2气体性质的装置如图所示:

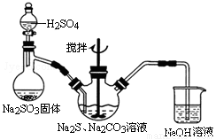
(2)装置Ⅰ中的现象是 ,说明SO2具有 (填“氧化”或“还原”)性。
写出装置Ⅰ中通入足量SO2的离子方程式 。
(3)在上述装置中通入过量的SO2,为了验证Ⅱ中发生了氧化还原反应,取Ⅱ中溶液分成两份,
并设计了如下实验:
方案一:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去;
方案二:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案不合理的方案是 ,原因是 ,写出解释该原因的离子方程式 。
(4) SO2可以用来制备硫代硫酸钠,硫代硫酸钠可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等.实验室可通过Na2S、Na2CO3和SO2共同反应来制取Na2S2O3。写出如图所示装置中三颈瓶中由反应制取Na2S2O3的化学方程式
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西西安第一中学高二上期中考试化学试卷(解析版) 题型:选择题
反应 A+B→C 的反应速率方程式为:v=k c (A) c (B),v为反应速率,k为速率常数。当c (A)=c (B)=1mol/L时,反应速率在数值上等于速率常数。下列说法正确的是
A.只增大c (A)时,v也增大 B.只增大c (A)时,v值不变
C.只升高温度时,k值不变 D.只升高温度时,k值变小
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西忻州第一中学高一上期中考试化学试卷(解析版) 题型:选择题
相等物质的量的KClO3分别发生下述反应:
①有MnO2催化剂存在时,受热分解得到氧气;②若不使用催化剂,加热至470 ℃左右,得到KClO4(高氯酸钾)和KCl。下列关于①和②的说法不正确的是
A.都属于氧化还原反应
B.发生还原反应的元素相同
C.发生氧化反应的元素不同
D.生成KCl的物质的量相同
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北武汉华中师大一附中高一上期中化学卷(解析版) 题型:选择题
有Na2CO3、AgNO3、BaCl2、HCl及NH4NO3无标签溶液,为鉴别它们,取四支试管分别装入一种溶液,向上述四支试管中分别加入少许剩下的一种溶液A,下列结论错误的是
A.有三支试管出现沉淀时,则A是AgNO3溶液
B.若全部没有什么现象变化时,则A是NH4NO3溶液
C.一支试管出现气体,两支试管出现沉淀时,则A是HCl溶液
D.若只有两支试管出现沉淀时,则A是BaCl2溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北武汉第二中学高二上期中考试化学试卷(解析版) 题型:选择题
相同温度下,体积均为1.5 L的两个恒容容器中发生可逆反应:X2 (g)+3Y2(g)  2XY3(g) ΔH=-92.6 kJ·mol-1,实验测得有关数据如下表:
2XY3(g) ΔH=-92.6 kJ·mol-1,实验测得有关数据如下表:
容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
X2 | Y2 | XY3 | ||
① | 1 | 3 | 0 | 放热46.3 kJ |
② | 0.8 | 2.4 | 0.4 | Q(Q>0) |
下列叙述不正确的是( )
A、容器①中达到平衡时,Y2的转化率为50%
B、Q=27.78 kJ
C、相同温度下;起始时向容器中充入1.0 X2 mol 、3.0 mol Y2和2 mol XY3;反应达到平衡前v(正)>v(逆)
D、容器①、②中反应的平衡常数相等,K=
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北衡水冀州中学高一上月考三理化学卷(解析版) 题型:选择题
溶液中能大量共存,加入OHˉ有沉淀析出,加入H+能放出气体的是( )
A . Na+、HCO3-、Ca2+、Cl- B . Ba2+、K+、OH-、NO3-
C. H+、Fe3+、NH4+、SO42- D . Mg2+、Na+ 、Cl-、CO32-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一上学期期中测试化学试卷(解析版) 题型:填空题
(1)被称为“万能还原剂”的NaBH4溶于水发生反应:NaBH4+2H2O==NaBO2+4H2↑(已知:NaBH4中H为-1价),用双线桥分析电子转移情况:NaBH4+2H2O==NaBO2+4H2↑
反应中的还原剂是__________,被氧化的元素和被还原的元素的质量比是__________
(2)已知8NH3+3Cl2=6NH4Cl+N2反应中电子转移数为1.806×1023,则被氧化的物质的体积是_________(标准状况)
(3)在一定条件下, RO3n-和氟气发生如下反应:RO3n-+F2+2OH-=RO4-+2F-+H2O。从而可知在RO3n-中,元素R的化合价是________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com