
 已知:有机氯化剂磺酰氯SO2Cl2的制法:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0
已知:有机氯化剂磺酰氯SO2Cl2的制法:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0| c(SO2)/mol•L-1 | c(Cl2)/mol•L-1 | v/mol•L-1•S-1 |
| 1.0 | 1.0 | 1.0k |
| 2.0 | 1.0 | 2.0k |
| 2.0 | 4.0 | 8.0k |
分析 (1)反应放热反应物的总能量高于生成物总能量,结合盖斯定律分析;
(2)根据v=k•cm(SO2)•cn (Cl2),利用三组数据列式比较可计算m、n值.
(3)由v=$\frac{△c}{△t}$可知,v正与t的乘积为浓度减小量,v逆与t的乘积为浓度增加量,以此分析SO2的平衡浓度;
(4)①平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,压强之比等于物质的量之比;
②将nmolSO2与nmolCl2充入容积可变的密闭容器中,得到SO2Cl2,0.4nmol,则恒压容器中成正比例关系,则0.5nmol二氧化硫和0.5nmolCl2,反应生成SO2Cl20.2nmol;
(5)SO2Cl2遇水发生剧烈水解,且产生白雾,白雾是水解生成HCl与空气中水蒸气结合所致,则-SO2-基团结合2个-OH生成H2SO4;氯化银的溶解度远远小于Ag2SO4的溶解度,SO2Cl2溶于水所得溶液中c(H2SO4):c(HCl)=1:2,溶液中离子浓度为硫酸根离子的2倍,故AgCl最先沉淀,根据溶度积可知,溶液中c(Ag+)=$\frac{{K}_{sp}(AgCl)}{C(C{l}^{-})}$,c(SO42-)=$\frac{{K}_{sp}(A{g}_{2}S{O}_{4})}{{C}^{2}(A{g}^{+})}$,据此计算溶液中$\frac{{c}^{2}(C{l}^{-})}{c(S{O}_{4}^{2-})}$.
解答 解:(1)SO2(g)+Cl2(g)?SO2Cl2(g)△H<0①该反应放热,说明反应物的总能量高于生成物,
SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)△H1=akJ/mol②,依据盖斯定律将②-①得SO2Cl2(g)+SCl2(g)?2SOCl2(g)△H2=bkJ/mol③,说明②放出的热量多,③放出的热量少,a、b均为副值,所以a<b,
故答案为:<;
(2)v=k•cm(SO2)•cn (Cl2),设三组数据编号分别为①②③,
则有$\frac{②}{①}$=2m=2,m=1;$\frac{③}{②}$=4n=4,n=1,
故答案为:1;1;
(3)恒温下,若在容积固定的2L密闭容器中,充入SO2、Cl2各2mol,SO2的起始浓度为1mol/L,观察图象,纵坐标为SO2的反应速率,横坐标为时间,由微分法可知,二者之积为浓度,故V(正)×t(平衡)表示B向正反应方向进行时减少的浓度,V(逆)×t(平衡)表示SO2向逆反应方向进行时增大的浓度,故1-S(aob) 的面积表示SO2的平衡浓度,
故答案为:C;
(4)①设反应的二氧化硫物质的量为x,
SO2(g)+Cl2(g)?SO2Cl2(g)
起始量(mol) n n 0
变化量(mol) x x x
平衡量(mol)n-x n-x x
起始气体总体积为10L,t min时反应达到平衡,此时气体总体积为8L,$\frac{2n}{2n-2x+x}$=$\frac{10}{8}$,x=$\frac{2}{5}$n,在一定条件下达到平衡状态时,体系的总压强为P,其中SO2(g)、Cl2(g)、SO2Cl2(g)物质的量分别为0.6nmol、0.6nmol、0.4nmol,压强之比等于物质的量之比,Kp=$\frac{\frac{0.4nmol}{0.6nmol+0.6nmol+0.4nmol}P}{(\frac{0.6nmol}{0.6nmol+0.6nmol+0.4nmol}P)^{2}}$=$\frac{16}{9P}$,
故答案为:$\frac{16}{9P}$;
②将nmolSO2与nmolCl2充入容积可变的密闭容器中,得到SO2Cl2,0.4nmol,则恒压容器中成正比例关系,相同条件下,若将0.5nmolSO2与0.5nmolCl2充入该容器,到达平衡状态时,消耗二氧化硫物质的量为0.2n,混合物中SO2Cl2的物质的量是0.2nmol,
故答案为:0.2n;
(5)SO2Cl2遇水发生剧烈水解,且产生白雾,白雾是水解生成HCl与空气中水蒸气结合所致,则-SO2-基团结合2个-OH生成H2SO4,反应方程式为:SO2Cl2+2H2O=H2SO4+2HCl,Ksp(AgCl)=1.8×10-10,Ksp(Ag2SO4)=1.4×10-5,氯化银的溶解度远远小于Ag2SO4的溶解度,SO2Cl2溶于水所得溶液中c(H2SO4):c(HCl)=1:2,溶液中离子浓度为硫酸根离子的2倍,故AgCl最先沉淀,即最先生成的沉淀是Cl-,当第二种离子SO4 2-开始沉淀时,溶液中c(Cl-)=1×10-5mol/L,c(Ag+)=$\frac{{K}_{sp}(AgCl)}{C(C{l}^{-})}$=$\frac{1.8×1{0}^{-10}}{1×1{0}^{-5}}$=1.8×10-5,c(SO42-)=$\frac{{K}_{sp}(A{g}_{2}S{O}_{4})}{{C}^{2}(A{g}^{+})}$=$\frac{1.4×1{0}^{-5}}{(1.8×1{0}^{-5})^{2}}$,溶液中$\frac{{c}^{2}(C{l}^{-})}{c(S{O}_{4}^{2-})}$=$\frac{(1×1{0}^{-5})^{2}}{\frac{1.4×1{0}^{-5}}{(1.8×1{0}^{-5})^{2}}}$≈2.3×10-15.
故答案为:SO2Cl2+2H2O=H2SO4+2HCl;Cl-;2.3×10-15.
点评 本题考查反应热大小比较、反应速率、化学平衡、溶度积有关计算等,关键是明确原理以及对信息获取应用,需要学生具备扎实的基础与灵活运用的能力,题目难度较大.


 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:解答题
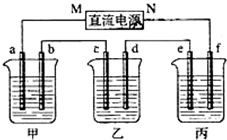 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
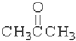 ③
③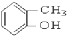 ④
④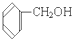 ⑤
⑤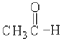 ⑥
⑥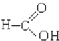
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ③⑤⑥ | C. | ②④⑤ | D. | 全部错误 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 生物质资源是一种污染小的可再生能源,可由其制得多种化工原料,如甲醛、甲醇和二甲醚等.
生物质资源是一种污染小的可再生能源,可由其制得多种化工原料,如甲醛、甲醇和二甲醚等.| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2molH2 | 1mol CH3OH | 2molCO、4molH2 |
| CH3OH平衡时浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | a1 | a2 | a3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol | B. | 0.4 mol | C. | 0.8 mol | D. | 0.9 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
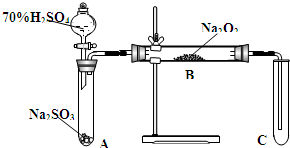 类比思想是化学学习常用的方法.已知Na2O2能与CO2反应,甲同学受到启发,提出一个相似的观点:Na2O2与SO2也能够反应.该同学用如图所示的装置进行实验,充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.
类比思想是化学学习常用的方法.已知Na2O2能与CO2反应,甲同学受到启发,提出一个相似的观点:Na2O2与SO2也能够反应.该同学用如图所示的装置进行实验,充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中C失去电子,被还原 | |
| B. | 该反应中氢气得到电子,被还原 | |
| C. | 该反应中,每转移2mole-则生成1mol氢气. | |
| D. | 该反应属于复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期第IA族 | B. | 第四周期第IA族 | C. | 第五周期第IA族 | D. | 第二周期第IIA族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com