
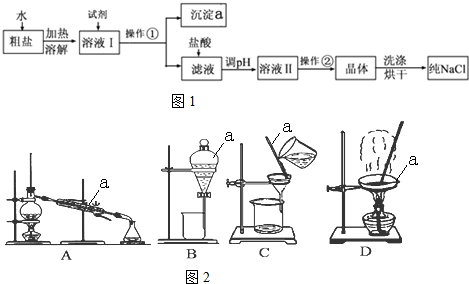
分析 (1)粗盐中除含泥沙外,还含有可溶性CaCl2、MgCl2及一些硫酸盐,除去钙离子用碳酸钠,除去硫酸根离子用氯化钡,除去镁离子用氢氧化钠,由于加入的试剂都是过量的,且用碳酸钠溶液除去过量的氯化钡,则碳酸钠溶液应该放在氯化钡之后,所以得到纯净的食盐步骤为:①溶解;②加入稍过量的氯化钡溶液;③加入稍过量的NaOH溶液; ④加入稍过量的碳酸钠溶液;⑤过滤除去泥沙和沉淀;⑥滴入稀盐酸至无气泡产生,除去过量的氢氧化钠、碳酸钠;最后通过⑦蒸发除去过量HCl得到NaCl晶体,据此进行解答;
(2)若硫酸根离子被除尽,则再加入氯化钡溶液时不会生成沉淀;
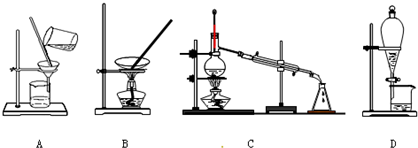
(3)图示装置A、B、C、D分别为过滤、蒸发、蒸馏、分液,不会用到分液和蒸馏;
(4)根据各操作方法分别判断玻璃杯的作用和目的;
(5)1000mL 2mol/L的氯化钠溶液中含有NaCl的物质的量为:2mol/L×1L=2mol,分别根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算出各物质的物质的量,根据计算结果进行判断.
解答 解:(1)粗盐中除含泥沙外,还含有可溶性CaCl2、MgCl2及一些硫酸盐,除去钙离子用碳酸钠,除去硫酸根离子用氯化钡,除去镁离子用氢氧化钠,由于加入的试剂都是过量的,且用碳酸钠溶液除去过量的氯化钡,则碳酸钠溶液应该放在氯化钡之后,所以得到纯净的食盐步骤为:①溶解;②加入稍过量的BaCl2溶液;③加入稍过量的NaOH溶液; ④加入稍过量的Na2CO3溶液;⑤过滤除去泥沙和沉淀;⑥滴入稀盐酸至无气泡产生,除去过量的氢氧化钠、碳酸钠;最后通过⑦蒸发除去过量HCl得到NaCl晶体,
故答案为:BaCl2; Na2CO3;
(2)检验SO42-是否除尽的方法是:取上层清液(或在上层清液处),滴加几滴BaCl2溶液,若无白色沉淀生成,说明SO42-已经除尽,反之,则SO42-没有除尽,
故答案为:无白色沉淀;
(3)装置A为过滤,装置B为蒸发,装置C为蒸馏,装置D为分液,粗盐提纯过程中用到过滤和蒸发,不会用到蒸馏和分液,
故答案为:AB;
(4)①过滤操作中玻璃杯的作用为引流,使溶液顺利流到漏斗中,②蒸发操作中玻璃杯的作用为搅拌,使液体混合均匀,③溶解过程中玻璃杯的作用是搅拌,目的是加速溶解,④向容量瓶中转移液体时玻璃杯的作用是引流,使液体顺利流动容量瓶中,
根据分析可知,玻璃杯的作用和目的完全相同的为①④,
故答案为:①④;
(5)1000mL 2mol/L的氯化钠溶液中含有NaCl的物质的量为:2mol/L×1L=2mol,
A.标准状况下33.6LH2的物质的量为:$\frac{33.6L}{22.4L/mol}$=1.5mol;
B.所含电子的物质的量为4mol的H2的物质的量为:n(H2)=$\frac{4mol}{2}$=2mol;
C.20℃54gH2O的物质的量为:$\frac{54g}{18g/mol}$=3mol;
D.常温下,16gO2与14gN2的混合气体总物质的量为:$\frac{16g}{32g/mol}$+$\frac{14g}{28g/mol}$=1mol;
E.含原子总数约为1.204×1024的NH3的物质的量为:n(NH3)=$\frac{1.204×1{0}^{24}}{6.02×1{0}^{23}mo{l}^{-1}}$×$\frac{1}{4}$=0.5mol;
根据分析可知,物质的量为2mol的为B;
根据N=nNA可知,物质的量越大含有分子数越多,则含有分子数最多的为C,
故答案为:B; C.
点评 本题考查了物质分离与提纯方法的综合应用及物质的量的计算,题目难度中等,明确除杂试剂及加入顺序为解答关键,注意掌握物质的量与摩尔质量、气体摩尔体积、阿伏伽德罗常数等之间的关系,试题培养了学生的分析能力及化学实验、化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 羟基和氢氧根离子有相同的化学式和结构式 | |
| B. | 乙醇的官能团是羟基 | |
| C. | NaOH中含有羟基 | |
| D. | 乙醇与钠反应中,羟基被取代 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| B. | 稀硫酸与Ba(OH)2溶液混合:SO42-+Ba2+═BaSO4↓ | |
| C. | 稀硝酸滴在大理石上:CaCO3+2H+═Ca2++H2CO3 | |
| D. | 氧化铁与稀盐酸混合:Fe2O3+6H+═2Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能全部透过半透膜 | B. | 所得物质一定为悬浊液或乳浊液 | ||
| C. | 所得混合物一定能导电 | D. | 有丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶解粗盐时,应尽量让溶液稀些,防止食盐不完全溶解 | |
| B. | 滤去不溶性杂质后,将滤液移至坩埚内加热浓缩 | |
| C. | 将制得的晶体转移到新制过滤器中用大量水进行洗涤 | |
| D. | 当蒸发到剩余少量液体时,停止加热,利用余热将液体蒸干 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com