
| A、碘化铵和氯化铵受热分解过程中破坏和形成的化学键类型完全相同 |
| B、反应N2H4(I)═N2(g)+2H2(g)是一个△S>0的反应 |
| C、40g金刚砂(SiC)中含有C-Si键的个数为2NA(NA为阿伏加德罗常数) |
| D、HClO是弱酸,所以NaClO是弱电解质 |


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| 选项 | 离子组 | 评价 |
| A | H+、Mg2+、Br-、NO3- | 能大量共存于同一溶液中,投入少量锌粉后,可放出H2 Zn+2H+=2Zn2++H2↑ |
| B | NH4+、CO32-、Cl-、Al3+ | 不能大量共存于同一溶液中,因为有沉淀生成 2Al3++3CO32-=Al2(CO3)3↓ |
| C | C6H5O-、Na+、K+、HSO3- | 能大量共存于同一溶液中 |
| D | HCO3-、OH-、Na+、K+ | 不能大量共存于同一溶液中,因为发生如下反应 HCO3-+OH-=CO32-+H2O |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(OH-)=1×10-11mol?L-1 |
| B、pH=3的CH3COOH溶液 |
| C、pH=4的H2SO4溶液 |
| D、c(H+)=1×10-3mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入Al2(SO4)3溶液 |
| B、加入硅酸胶体 |
| C、加热 |
| D、加入Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用升华法分离碘和NaCl的混合物 |
| B、用结晶法分离KNO3和NaCl的混合物 |
| C、用分液法分离水和汽油的混合物 |
| D、用蒸馏法分离乙醇(沸点为78℃)和乙酸乙酯(沸点为77.5℃)的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3,3-二甲基丁烷 |
| B、3-甲基-3-乙基戊烷 |
| C、4-甲基-3-乙基-2-己烯 |
| D、1-甲基-2-乙基-3-丙基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)>c(CN-)>c( OH-)>c(H+) |
| B、c(CN-)>c(Na+)>c(H+)>c( OH-) |
| C、c(Na+)+c(CN-)=2mol/L |
| D、c(Na+)+c( OH-)=c(CN-)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、188.3 L |
| B、4.0×1010L |
| C、4.0×106L |
| D、8.0×106 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 用装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液 |
B、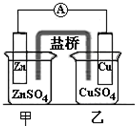 装置的盐桥中KCl的Cl-移向甲烧杯 |
C、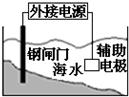 装置中钢闸门应与外接电源的正极相连获得保护 |
D、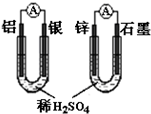 两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com