
分析 (1)反应中有4mol N-H键断裂,生成1.5molN2,根据结构式N≡N判断;
(2)根据分子中δ键和孤电子对数判断杂化类型和分子的空间构型;
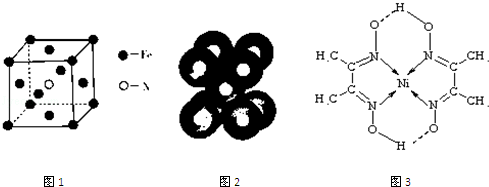
(3)铁和氨气在640℃可发生置换反应生成氮气和氮化铁,利用均摊法确定氮化铁的化学式,根据温度、反应物和生成物写出反应方程式;
(4)a.根据氮气中的共价键分析;
b.利用均摊法确定其晶胞中的原子数;
c.非金属性越强,第一电离能越大,同周期从左到右第一电离能增大,第IIA与第IIIA,第VA族与第VIA反常;
d.离子半径越小,晶格能越大;
(5)根据图可知碳碳间、碳氮间为共价键,氮镍间为配位键,氧氢间有氢键;
(6)根据碳原子成键类型判断.
解答 解:(1)1mol氮气分子中含有2molπ键,若该反应中有4mol-H键断裂,即有1mol肼参加反应,生成1.5mol氮气,所以形成的π键有1.5mol×2=3mol,
故答案为:3mol;
(2)NF3中含有3个δ键,且孤电子对数为$\frac{5-3}{2}$=1,则应为sp3杂化,空间构型为三角锥形,
故答案为:三角锥形;
(3)该晶胞中铁原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氮原子个数是1,所以氮化铁的化学式是Fe4N,铁和氨气在640℃可发生置换反应生成氮气和氮化铁,所以该反应方程式为:8Fe+2NH3$\frac{\underline{\;640℃\;}}{\;}$2Fe4N+3H2,
故答案为:8Fe+2NH3$\frac{\underline{\;640℃\;}}{\;}$2Fe4N+3H2;
(4)a.氮气中存在N≡N,N≡N的键能很大,不容易断裂,所以N2很稳定,故a错误;
b.钠晶胞中Na占据8个顶点和中心,根据均摊法确定其晶胞中的原子数为:8×$\frac{1}{8}$+1=2,故b正确;
c.非金属性越强,第一电离能越大,同周期从左到右第一电离能增大,第IIA与第IIIA,第VA族与第VIA反常,所以第一电离能:N>O>P>S,故c正确;
d.离子半径越小,晶格能越大,半径:Na+<K+,则晶格能:NaN3>KN3,故d错误;
故答案为:bc;
(5)根据图可知碳碳间形成非极性共价键、碳氮间为极性共价键,氮镍间为配位键,氧氢间形成氢键,
故选:abcd;
(6)根据图可知,碳碳间形成单键,为sp3杂化,有的碳碳间形成双键,为sp2杂化,
故答案为:sp3、sp2.
点评 本题综合性较大,涉及晶体、化学键、杂化轨道、晶胞计算等,题目难度大,注意运用杂化理论推导分子构型,为易错点,侧重于考查学生对所学知识的综合应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. |  | ||
| C. |  | D. | 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3、Na2O2 | B. | Na2CO3 | ||
| C. | NaOH、Na2CO3 | D. | Na2O2、NaOH、Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 打开啤酒瓶盖,产生大量气泡 | |
| B. | 稀释CH3COOH时,溶液中CH3COO-数目增多 | |
| C. | 工业合成氨常用500℃左右的温度 | |
| D. | 热的纯碱溶液的去污效果比冷的好 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡含有食品添加剂的食物对人体健康均有害 | |
| B. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| C. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| D. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
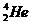 ;
;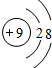 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com