
将NaOH溶液逐滴加入NH4HCO3溶液中(忽略溶液体积的变化),下列各示意图表示的混合溶液有关量的变化趋势正确的是
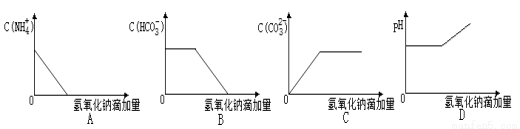
C
【解析】
试题分析:A.将NaOH溶液逐滴加入NH4HCO3溶液中,随着反应的进行,c(NH4+)会逐渐减小,但是即使是完全反应产生NH3·H2O,该物质是弱电解质,会电离产生铵根离子,所以最后c(NH4+)不会变为0,错误;B. 将NaOH溶液逐滴加入NH4HCO3溶液中,首先发生反应:HCO3-+OH-=H2O+CO32-,所以c(HCO3-)会逐渐减小,最后为0,错误;C. 将NaOH溶液逐滴加入NH4HCO3溶液中,首先发生反应:HCO3-+ OH-=H2O+CO32-,所以c(CO32-)会逐渐增大,当HCO3-完全反应后c(CO32-)达到最大值,后发生反应:NH4++OH-=NH3·H2O,但是c(CO32-)不变,正确;D. 将NaOH溶液逐滴加入NH4HCO3溶液中,由于发生反应:HCO3-+OH-=H2O+CO32-;NH4++OH-=NH3·H2O,所以溶液中c(OH-)会逐渐减小,溶液的pH 会减小,与图像不符合,错误。
考点:考查图像法在离子反应、溶液的酸碱性的应用的知识。


科目:高中化学 来源:2015届广东省广州市海珠区高三8月摸底考试理综化学试卷(解析版) 题型:填空题
(16分)二氧化钛(TiO2)又称钛白,工业上利用钛铁矿(主要成分FeTiO3,其中铁为正二价)为原料,采用硫酸法制得,其工艺流程如下图所示
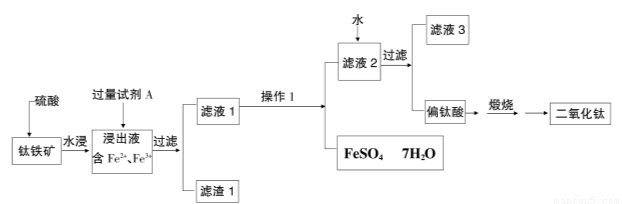
请回答:
(1)铁矿加入硫酸反应可制得硫酸氧钛,其反应的化学方程式为:
FeTiO3+ 2H2SO4=( )TiOSO4+( )+( );
(2)为了提高二氧化钛的纯度,需要除去浸出液中的Fe3+,则加入的试剂A为 ,需过量的原因是 。
(3)操作1是 。
(4)进行操作1时需将滤液1在70-75℃,压力8000Pa的条件下真空蒸发器中进行,其原因是为了防止 ,滤液2加水稀释使硫酸氧钛(TiOSO4)水解生成偏钛酸(TiO2·nH2O),请写出该水解反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2015届安徽省六校教育研究会高三第一次联考化学试卷(解析版) 题型:填空题
C、O、Na、Al、S、Cl是常见的六种元素
(1)C元素位于元素周期表第 周期,第 族;C元素的一种同位素可以测定文物年代,这种同位素的符号为
(2)用“大于”“小于”或“等于”填空
离子半径 | 酸性 | 还原性 | 得电子能力 |
N3- Al3+ | H2SO4 HClO4 | O2- S2- | 35Cl 37Cl |
(3)① CaCO3和适量HCl溶液反应时,每产生4.4 g 气体(不考虑气体溶解),放热a kJ,则该反应的热化学方程式为 。
②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得pH变化曲线如图所示
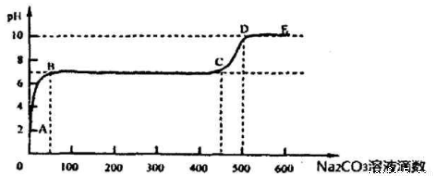
请用离子方程式表示B-C段发生的反应:
(4)氢气、氧气常用来作燃料电池,写出电解质为氢氧化钠溶液时负极上的电极方程式
查看答案和解析>>
科目:高中化学 来源:2015届安徽省六校教育研究会高三第一次联考化学试卷(解析版) 题型:选择题
在恒温恒压下,向密闭容器中充入4molSO2和2molO2,发生如下反应:
2SO2(g)+O2(g) 2SO3(g) △H<0 。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量Q kJ,则下列分析正确的是
2SO3(g) △H<0 。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量Q kJ,则下列分析正确的是
A.在该条件下,反应前后的压强之比为6 :5.3
B.若反应开始时容器体积为2L,则v(SO3)=0.35mol/(L·min)
C.若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3) < 1.4mol
D.若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ
查看答案和解析>>
科目:高中化学 来源:2015届安徽省六校教育研究会高三第一次联考化学试卷(解析版) 题型:选择题
下列各溶液中,一定能大量共存的是
A.Fe3+、Na+、SO42-、H2O2B.C2H5OH、MnO4-、H+ 、K+
C.Pb2+、K+ 、SO42-、Cl- D.Na+、SO32- 、CH3COO-、S2-
查看答案和解析>>
科目:高中化学 来源:2015届安徽望江中学同步课时练(人教选修4)4.1原电池试卷(解析版) 题型:选择题
将等质量的两份锌粉a、b分别加入过量的稀硫酸,同时向a中加少量的CuSO4溶液,如各图中产生H2的体积V(L)与时间t(min)的关系,正确的是( )

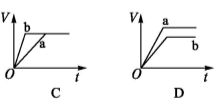
查看答案和解析>>
科目:高中化学 来源:2015届安徽望江中学同步课时练(人教选修4)2.3化学平衡移动试卷(解析版) 题型:选择题
下列能确认化学平衡发生了移动的是( )
A.化学反应速率发生改变
B.有气态物质参加的可逆反应达到平衡后,改变压强
C.由于某一条件的改变,使平衡体系中各组分的浓度发生了不同程度的改变
D.可逆反应达到平衡后,使用催化剂
查看答案和解析>>
科目:高中化学 来源:2015届安徽师大附中高二下学期期中考查化学试卷(解析版) 题型:选择题
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是( )

A.该反应为放热反应
B.该反应焓变可表示为△H=-(E1-E2)kJ·mol-1
C.催化剂能降低反应的活化能
D.催化剂能改变反应的焓变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com