
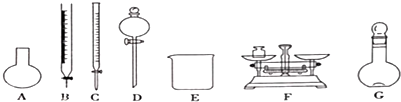
| A. | 需要称量NaClO固体的质量为144.0g | |
| B. | 定容摇匀后,若溶液液面低于容量瓶刻度线.不必再加水定容 | |
| C. | 除从如图所示的仪器中选择需要的以外.还-种玻填仪器 | |
| D. | 容量瓶用蒸馏水洗净后应烘干才能用于溶液配制.否則结果偏低 |
分析 A.容量瓶的规格没有480mL,应选取500 mL的容量瓶进行配制;
B.定容摇匀后,若溶液液面低于容量瓶刻度线再加水定容,会导致体积偏大,浓度偏小;
C.需要玻璃棒搅拌、引流,定容需要胶头滴管;
D.配制过程中需要加入水,所以经洗涤干净的容量瓶不必烘干后再使用.
解答 解:A.应选取500 mL的容量瓶进行配制,然后取出480mL即可,所以需要NaClO的质量:500mL×1.2 g•cm-3×25%=150.0g,故A错误;
B.定容摇匀后,部分溶液附着在刻度线以上的内壁及玻璃塞上导致溶液液面低于容量瓶刻度线,如再加水定容,会使溶液体积偏大,浓度偏小,故B正确;
C.需用托盘天平称量NaClO固体,需用烧杯来溶解NaClO,需用玻璃棒进行搅拌和引流,需用容量瓶和胶头滴管来定容,图示的A,B、C、D不需要,但还需玻璃棒和胶头滴管,故C错误;
D.配制过程中需要加入水,所以经洗涤干净的容量瓶不必烘干后再使用,故D错误;
故选B.
点评 本题考查了一定物质的量浓度溶液配制的步骤、仪器以及误差分析等,难度不是很大,注意计算溶质的质量时,溶液的体积按500mL计算.


科目:高中化学 来源: 题型:选择题
| A. | 使用可再生资源、用超临界二氧化碳替代有机溶剂、注重原子的经济性、采用低能耗生产工艺等都是绿色化学的内容 | |
| B. | 食盐、食醋、食用油均可用作食品添加剂,都属于有机物 | |
| C. | 碳酸钡、碳酸氢钠、氢氧化铝均可作为抗酸药物使用 | |
| D. | 石油分馏、煤的气化、海水晒盐、碱去油污、花生中提取花生油等过程都是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4 g金属镁变为镁离子时失去的电子数为0.1NA | |
| B. | 在标准状况下,22.4 LCH4与18 g H2O所含有的电子数均为10NA | |
| C. | 22.4 L CO气体与l molN2所含的电子数相等 | |
| D. | 1 mol HCl气体中的分子数与2L0.5 mo1/L盐酸中溶质分子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 由N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ•mol-1热化学方程式可知,当反应中转移6NA电子 时,反应放出的热小于92.4 kJ | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 在101 kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -定量的Fe与含1molHNO3,的稀硝酸恰好反应,被还原的氮原子数小于NA | |
| B. | 1mol A1Cl3在熔融时离子总数为0.4NA | |
| C. | 常温常压下,等质量的S02、S2含有相同的分子数 | |
| D. | 125g CuS04•5H20 品体中含有0.5NA个Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com