
【题目】NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒.已知NaNO2能发生如下反应:
2NaNO2+4HI═2NO↑+I2+2NaI+2H2O.
(1)上述反应中氧化剂是 .
(2)根据上述反应,鉴别NaNO2和NaCl.可选用的物质有:①水 ②碘化钾淀粉试纸 ③淀粉 ④白酒 ⑤食醋,你认为必须选用的物质有 (填序号).
(3)某厂废液中,含有2%~5%的NaNO2 , 直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是 .
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
(4)请配平以下化学方程式
Al+ NaNO3+ NaOH═ NaAlO2+ N2↑+ H2O
若反应过程中转移5mol 电子,则生成标准状况下N2的体积为 L.
【答案】NaNO2;②③⑤;B;10;6;4;10;3;2;1.12
【解析】(1)反应中N元素的化合价降低,I元素的化合价升高,则氧化剂是NaNO2 , 所以答案是:NaNO2;
(2)由2NaNO2+4HI═2NO↑+I2+2NaI+2H2O可知,鉴别NaNO2和NaCl,则选择②碘化钾淀粉试纸、③淀粉、⑤食醋,变蓝的为NaNO2 , 所以答案是:②③⑤;
(3)NaNO2具有氧化性,能使NaNO2转化为不引起二次污染的N2的物质应具有还原性,只有选项B符合,所以答案是:B;
(4)Al元素的化合价由0升高为+3价,N元素的化合价由+5价降低为0,该反应还应生成水,由电子守恒及原子守恒可知,反应为10Al+6NaNO3+4NaOH═10NaAlO2+3N2↑+2H2O,过程中转移5mol e﹣ , 则生成标准状况下N2的体积为5mol×![]() ×22.4L/mol=1.12L,
×22.4L/mol=1.12L,
所以答案是:10;6;4;10;3;2;1.12.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】下图是一些含氯产品。

(1)储氯钢瓶中应贴的标签为_________(填字母代号)。
A.易燃品 B.有毒品 C.爆炸品
(2)“威猛先生”使用注意事项中特别说明在使用时切勿与漂白剂一同使用,否则会产生有害气体。“84”消毒液的有效成分是次氯酸钠,写出“84”消毒液与“威猛先生”(有效成分为盐酸)混合后反应的离子方程式_______。
(3)漂白粉的有效成分是_______(填化学式),老师新买的漂白粉没有保存说明书,请你为漂白粉设计一份保存注意事项,并用化学用语解释设计原因。
注意事项(不超过30个字):_________________。
解释(用化学用语):___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青铜(Cu-Zn)是我国最早大量使用的合金,其中锌是现代工业上常用金属。
I. 某废催化剂含58.2%的SiO2(不溶于水和稀酸)、21.0%的ZnO、4.5%的ZnS(不溶于水但溶于稀酸)和12.8%的CuS(不溶于水也不溶于稀酸)。某同学用15.0 g该废催化剂为原料,以稀硫酸和H2O2为试剂,回收其中的锌和铜。
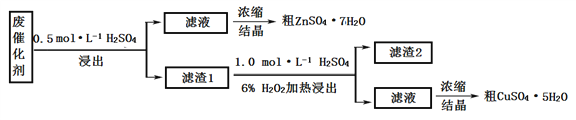
(1)浸出后的操作中,使用到的玻璃仪器有:烧杯、玻璃棒、__________________。
(2)滤渣2是______,第二次浸出发生的反应化学方程式是_________________________。
(3)两次结晶的操作是_________________________________________________________。
(4)某同学在实验完成之后,得到1.5gCuSO4·5H2O(M=250 g·mol–1),则铜的回收率为_______。
II.锌的化学性质与铝相似,锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+。回答下列问题:
(5)Al溶于NaOH溶液,反应的离子方程式为:_______________________________。
(6)Zn溶于NaOH溶液,反应的化学方程式为:_______________________________。
(7)下列各组中的两种溶液,用相互滴加的实验方法不可鉴别的是____________。
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和氢氧化钠 ④硫酸锌和氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面三个图是某研究小组利用过氧化氢酶探究H2O2分解条件而获得的实验结果.请回答下列有关问题:

(1)图1、2、3所代表的实验中,实验自变量依次为 , , .
(2)根据图1可以得出的实验结论是 _.
(3)图2曲线bc段产生的最可能原因是 .
(4)若进行图2所代表的实验时增加过氧化氢酶的含量,请在图2中,利用虚线绘出曲线的变化
(5)能否以H2O2为材料来探究温度对H2O2酶活性的影响? 为什么 .
(6)酶的作用原理 ,酶的本质 . .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,属于水解反应的是( )
A.CH3COOH+H2OCH3COO﹣+H3O+
B.SO2+H2OHSO3﹣+H+
C.HCO3﹣+OH﹣CO32﹣+H2O
D.NH4++H2ONH3H2O+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】增塑剂DCHP可由邻苯二甲酸酐与环己醇反应制得。( )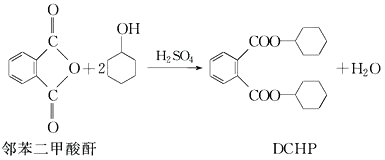
下列说法正确的是
A.邻苯二甲酸酐的二氯代物有2种
B.环己醇分子中所有的原子可能共平面
C.DCHP能发生加成、取代、消去反应
D.1 mol DCHP与氢氧化钠溶液反应,最多可消耗2 molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶体区别于其它分散系的本质特征是
A. 胶体粒子直径在1~100nm之间 B. 胶体粒子带电荷
C. 胶体粒子不能透过半透膜 D. 胶体能够发生丁达尔现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知数据:
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
乙醇 | -117.3 | 78.5 | 0.789 |
乙酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.90 |
浓硫酸(98%) | — | 338.0 | 1.84 |
实验室制取乙酸乙酯的主要步骤如下:①在30 mL的大试管A中按体积比1∶4∶4的比例配制浓硫酸、乙醇和乙酸的混合溶液;②按图1连接好装置(装置气密性良好),用小火均匀地加热装有混合液的大试管3~5 min;③待试管B收集到一定量产物后停止加热,撤去试管B并用力振荡,然后静置分层;

图1
④分离出乙酸乙酯层、洗涤和干燥。
请根据题目要求回答下列问题:
(1)写出制取乙酸乙酯的化学方程式:________________________________________________________________________。
(2)上述实验中饱和碳酸钠溶液的作用是______(填字母代号)。
A.反应掉乙酸和乙醇
B.反应掉乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的更小,有利于分层析出
D.加速酯的生成,提高其产率
(3)步骤②中需要用小火均匀加热,其主要原因是________________________________________________________________________。
(4)某化学课外小组设计了图2所示的制取乙酸乙酯的装置(铁架台、铁夹、加热装置均已略去),
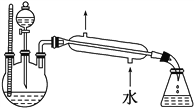
图2
与图1所示装置相比,此装置的主要优点有________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol·L-1r溶液的pH为2,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是( )

A. 原子半径的大小W <X<Y B. 元素的非金属性Z>X>Y
C. Y的氢化物常温常压下为液态 D. X的最高价氧化物的水化物为强酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com