
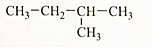
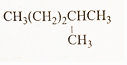 (4)
(4)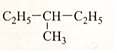 (5)(CH3)2CH-CH2-CH2-CH3.
(5)(CH3)2CH-CH2-CH2-CH3. 分析 同分异构体是指分子式相同,但结构不同的化合物,依据选项中结构简式命名、书写分子式,分析分子式相同的不同结构的为同分异构体.
解答 解:(l) CH3-CH2-CH2-CH2-CH3 名称为戊烷,分子式为C5H12;
(2)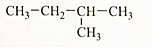 名称为2-甲基丁烷,分子式为C5H12;
名称为2-甲基丁烷,分子式为C5H12;
(3)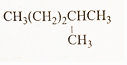 名称为2-甲基戊烷,分子式为C6H14;
名称为2-甲基戊烷,分子式为C6H14;
(4)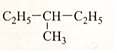 名称为3-甲基戊烷,分子式为C6H14;
名称为3-甲基戊烷,分子式为C6H14;
(5)(CH3)2CH-CH2-CH2-CH3名称为2-甲基戊烷,分子式为C6H14;
上述物质互为同分异构体的是(1)(2);(3)(4)或(5)(4);
故答案为:(1)(2)、(3)(4)或(5)(4).
点评 本题考查同分异构体、物质的名称与化学式等,难度不大,注意化学式书写相同、名称相同的物质容易认为是同分异构体,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 金刚石和石墨互为同素异形体 | |
| B. | Na的还原性强于金刚石 | |
| C. | 46g Na完全反应需要标准状况下CO2的体积为33.6L | |
| D. | 当有0.4mo1 Na参与反应时,被还原的CO2的分子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤、石油、天然气均为化石燃料,它们属于不可再生资源 | |
| B. | 植物燃料燃烧时放出的能量来源于太阳能 | |
| C. | 氢气是具有热值高、无污染等优点的燃料 | |
| D. | 煤燃烧是化学能只转化为热能的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 利用某有机物之间的转换可以贮存太阳能,如原降冰片二烯(NBD)经太阳光照可转化成四环烷(Q),其反应式可表示为:△H=+88.62kJ/mol下列有关说法不正确的是( )
利用某有机物之间的转换可以贮存太阳能,如原降冰片二烯(NBD)经太阳光照可转化成四环烷(Q),其反应式可表示为:△H=+88.62kJ/mol下列有关说法不正确的是( )| A. | 物质NBD比Q稳定 | |
| B. | NBD和Q互为同分异构体 | |
| C. | 物质NBD和Q的核磁共振氢谱图都有3个峰,但峰面积不同 | |
| D. | 一定条件下,1 mol NBD最多可与2 mol Br2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合物里3种物质反应时消耗盐酸的物质的量浓度之比为1:1:3 | |
| B. | 反应后所得溶液中的Fe2+离子与Cl-离子的物质的量浓度之比为1:1 | |
| C. | 混合物里,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多 | |
| D. | 混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧碱、液态氧、碘酒 NaCl、酒精 | |
| B. | 生石灰、白磷、熟石灰 熔融NaCl、BaSO4 | |
| C. | 干冰、铁、氯化氢 铜、二氧化硫 | |
| D. | 空气、氮气、胆矾 熔融的KNO3、硫酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 容器 | 甲 | 乙 | ||
| 反应物 | CO | H2O | CO | H2O |
| 起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
| 平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
| 达到平衡的时间(min) | t 1 | t 2 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
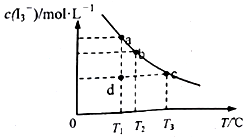 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)═I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)下列说法不正确的是( )
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)═I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)下列说法不正确的是( )| A. | 温度为T1时,向该平衡体系中加入KI固体,平衡正向移动 | |
| B. | 反应I2(aq)+I-(aq)═I3-(aq)△H<0 | |
| C. | 若T1时,反应进行到状态d时,一定有v正>v逆 | |
| D. | 状态a与状态b相比,状态b时I2的转化率更高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com