
����Ŀ����1��������һ��������Դ��ũ����ڴ����Ľոѡ��Ӳݵȷ�������Ǿ������֮��ɲ��������������������������ũ���ƹ㽨�������أ���������Ч������
�ܣ�����Ϊũҵ�����ṩ�����ķ��ϡ���֪�� ��״���µ�112.0L CH4������ȫȼ�գ�����CO2��Һ̬ˮ���ų�4448kJ��������
��д��CH4��ȫȼ�յ��Ȼ�ѧ����ʽΪ ��
�����������Ӧ���ɵ���ˮ��������Ӧ�ų������� 4448kJ�������������������
��2����֪��1 mol H��H����1 molN��N��1 mol N��H���ֱ���Ҫ���յ�����Ϊ436 .4kJ��941.3 kJ��390.5 kJ������1 mol NH3 �ֽ����������͵�����Ҫ ����ų��������ա��� kJ��������
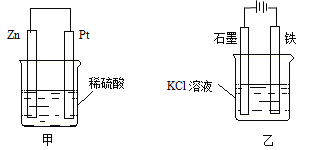
��3���������������о���������ѧ������ܵ��ת���������мס�����װ���У����и����缫��ӦʽΪ ���������缫�ĵ缫��ӦʽΪ �����缫���� ��Ӧ�����������ԭ������
���𰸡���1�������� CH4(g)+2O2(g)=CO2(g)+2H2O(l) ��H= -889.6KJmol-1 ��
��2������ 46.25��3��Zn-2e-=Zn2+ 2H++2e-=H2�� ��ԭ
��������
�����������1����ũ���ƹ㽨�������أ���������Ч�������������ܣ�����Ϊũҵ�����ṩ�����ķ��ϡ���״���µ�112.0L�����ʵ���Ϊ5mol CH4������ȫȼ�գ�����CO2��Һ̬ˮ���ų�4448kJ����������1mol������ȫȼ�շų�����4448/5=889.6kJ��
��CH4��ȫȼ�յ��Ȼ�ѧ����ʽΪCH4(g) +2O2(g)=CO2(g)+2H2O(l) ��H= -889.6KJmol-1��
�����������Ӧ���ɵ���ˮ������Һ̬ˮ��Ϊˮ������Ҫ������������Ӧ�ų���������4448kJ��
��2�����ݷ�ӦN2+3H2![]() 2NH3���Լ���Ϣ��1 mol H��H����1 molN��N��1 mol N��H���ֱ���Ҫ���յ�����Ϊ436 .4kJ��941.3 kJ��390.5 kJ����֪����2molNH3�ų�������Ϊ390.5��6-��436 .4��3+941.3��=92.5 kJ������1mol NH3�ֽ����������͵�����Ҫ����92.5/2=46.25kJ��������
2NH3���Լ���Ϣ��1 mol H��H����1 molN��N��1 mol N��H���ֱ���Ҫ���յ�����Ϊ436 .4kJ��941.3 kJ��390.5 kJ����֪����2molNH3�ų�������Ϊ390.5��6-��436 .4��3+941.3��=92.5 kJ������1mol NH3�ֽ����������͵�����Ҫ����92.5/2=46.25kJ��������
��3������п���������缫��ӦʽΪZn-2e-=Zn2+���������缫���������缫��ӦʽΪ2H++2e-=H2�������缫������ԭ��Ӧ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��2����ѧ�뼼��]
���̿���Ҫ�ɷ�ΪMnO2���������Ʊ��̼��仯���
��1������ұ�������̵�һ�ַ��������������̿�����Mn3O4�����������ȷ�Ӧԭ���Ƶ��̣������ȷ�Ӧ�Ļ�ѧ����ʽΪ_______________��
��2���ִ�ұ�������̵�һ�ֹ�����������ͼ��ʾ��
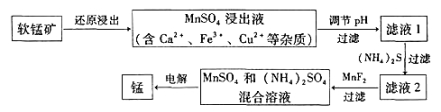
�±�Ϊt��ʱ���й����ʵ�pKsp��ע��pKsp =��lgKsp����
���� | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
pKsp | 37.4 | 19.32 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
���̿�ԭ�����ķ�ӦΪ��12MnO2��C6H12O6��12H2SO4 ![]() 12MnSO4��6CO2����18H2O
12MnSO4��6CO2����18H2O
���÷�Ӧ�У���ԭ��Ϊ_______��д��һ�������ԭ�������ʵĴ�ʩ��_______��
����Һ1��pH_______����������������С����������������MnSO4����Һ��pH��
�ۼ���MnF2����ҪĿ���dz�ȥ ����Ca2+��Fe3+��Cu2+����
��3����MnSO4��ȡMnCO3����MnSO4��Һ�м������NH4HCO3��Һ���÷�Ӧ�����ӷ���ʽΪ____________������MnSO4��Һ�м���(NH4)2CO3��Һ���������Mn(OH)2�����ܵ�ԭ������MnCO3(s)��2OH��(aq)![]() Mn(OH)2(s)��CO32-(aq)��t ��ʱ������÷�Ӧ��ƽ�ⳣ��K�� ������ֵ����
Mn(OH)2(s)��CO32-(aq)��t ��ʱ������÷�Ӧ��ƽ�ⳣ��K�� ������ֵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�������Դ����������ȡ�봢��������Դ����������о��ȵ㡣
I����֪�� �� 4HCl(g)+O2(g) ![]() 2Cl2��g��+2H2O��g����H=-115.6kJ/mol
2Cl2��g��+2H2O��g����H=-115.6kJ/mol
��H2��g��+Cl2��g��=2HCl��g����H=-184kJ/mol
��֪�Ͽ�1mol H-H����������Ϊ436kJ���Ͽ�1molO=O����������Ϊ496kJ���Ͽ�1molCl-Cl����������Ϊ243KJ����
��1��H2��O2��Ӧ������̬ˮ���Ȼ�ѧ����ʽ��
��2���Ͽ�1molH-O����������Ϊ kJ��
��.��֪�� CH4��g��+H2O��g���TCO��g��+3H2��g�� ��H=+206.2kJmol-1 ��
CH4��g��+CO2��g���T2CO��g��+2H2��g�� ��H=+247.4kJmol-1 ��
��֪CH4��ȼ����Ϊ890.3kJ/mol��
��1������������֪����д��������ȫȼ�յ��Ȼ�ѧ����ʽ�� ��
��2���Լ���Ϊԭ����ȡ�����ǹ�ҵ�ϳ��õ����ⷽ����CH4(g)��H2O(g)��Ӧ����CO2(g)��H2(g)���Ȼ�ѧ����ʽΪ________________________________��
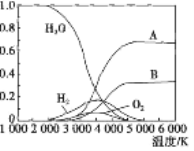
��3��������H2O�ɷֽ����ɷ��ӻ�ԭ�ӡ�������ˮ�ֽ���ϵ����Ҫ���������������¶ȵĹ�ϵ��ͼ��ʾ��ͼ��B��ʾ������_______�������ƣ�����������A��H2��ѧ�ܽϵ͵�������_______���ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״����Բ���Ͳ������ʯ��ȼ�ϣ�������Դ���š�����CO���Ժϳɼ״���
��1����֪��CO(g)+![]() O(g)=CO2(g) ��H1=��283.0kJ��mol��1
O(g)=CO2(g) ��H1=��283.0kJ��mol��1
H2(g)+ ![]() O2(g)=H2O(l) ��H2=��285.8kJ��mol��1
O2(g)=H2O(l) ��H2=��285.8kJ��mol��1
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l) ��H3=��764.5kJ��mol��1
O2(g)=CO2(g)+2H2O(l) ��H3=��764.5kJ��mol��1
��CO(g)��2H2(g)=CH3OH(g) ��H=__________kJ��mol��1
��2����ͼ�Ƿ�ӦʱCO��CH3OH(g)��Ũ����ʱ��ı仯������ӷ�Ӧ��ʼ����ƽ�⣬��H2��ʾƽ����Ӧ����v(H2)=____________________��
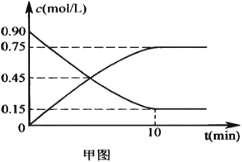
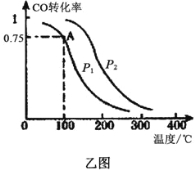
��3��һ�������£����ݻ�ΪVL���ܱ������г���amolCO��2amolH2�ϳɼ״���ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
��P1__________P2����������������������=����
���ü״��ϳɷ�Ӧ��A���ƽ�ⳣ��K=__________����a��V��ʾ��
�����д�ʩ���ܹ�ͬʱ��������Ӧ���ʺ����COת���ʵ���__________������д��Ӧ��ĸ��
A��ʹ�ø�Ч����B�����ͷ�Ӧ�¶�
C��������ϵѹǿD�����Ͻ�CH3OH�ӷ�Ӧ������з������
E������ϵ���ٳ���amolCO��2amolH2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��G��ǰ�����ڳ�ϡ������֮��ԭ�������������������Ԫ�ء�A������Ԫ�ؼȲ�ͬ�����ֲ�ͬ�壻B��C�ļ۵��Ӳ���δ�ɶԵ���������2��E�����s��p�ܼ��ĵ���������ȣ�F��Eͬ�����ҵ�һ�����ܱ�EС��G�ģ�1�����ӣ�G+���ĸ������ȫ�������ش��������⣺
��1��B�ĺ�������� �ֿռ��˶�״̬��д��F����Χ�����Ų�ͼ�� ��
��2�����ݵȵ�����ԭ����д��B22-���ӵĵ���ʽ�� ��
��3�����ݼ۲���ӶԻ�������(VSEPR)�Ʋ⣺A2C��VSEPRģ�����ƣ� ��
��4���ڲⶨA��D�γɵĻ��������Է�������ʱ��ʵ��ⶨֵһ���������ֵ����Ҫԭ���� ��
��5��C��SiΪͬһ�����Ԫ�أ�CO2��SiO2��ѧʽ���ƣ����ṹ�������кܴ�ͬ��CO2��C��Oԭ�Ӽ��γ� ������ ������SiO2��Si��Oԭ�Ӽ䲻�γ�������������ԭ�Ӱ뾶��С�ĽǶȷ�����Ϊ��C��Oԭ�Ӽ����γɣ���Si��Oԭ�Ӽ䲻���γ��������� ��
��6��E��һ�־���ṹ��ͼ�ף�����һ�������к��� ��E��G��D�γɵĻ�����ľ����ṹ��ͼ�ң��������ܶ�Ϊag/cm3����G��D����ľ���Ϊ pm���������ӵ�������NA��ʾ���г��������ʽ�����û���������ΪG����ΪD����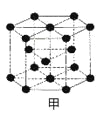
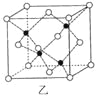
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����ĵ�������к���ͭ�����Ƚ��������Ϊʵ����Դ�Ļ������ò���Ч��ֹ������Ⱦ,������¹�������:

������ | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
��ʼ������pH | 2.3 | 7.6 | 4.4 |
��ȫ������pH | 3.2 | 9.7 | 6.4 |
��1����������H2O2��Ŀ���� ����pH�����м�����Լ������ (�ѧʽ)��ʵ���ҽ��й��˲������õ��IJ��������� �� �� ��
��2�����CuSO4��Һ��ԭ���� ����CuSO4��Һ�м���һ������NaCl��Na2SO3,�������ɰ�ɫ��CuCl����,д���÷�Ӧ�Ļ�ѧ����ʽ ��
��3��Fe3+����ˮ�ⷴӦFe3++3H2O![]() Fe(OH)3+3H+,�÷�Ӧ��ƽ�ⳣ������ʽΪ ��
Fe(OH)3+3H+,�÷�Ӧ��ƽ�ⳣ������ʽΪ ��
��4����ȡ���Ʊ���CuCl��Ʒ0.250 0 g����һ������0.5 mol��L-1FeCl3��Һ��,����Ʒ��ȫ�ܽ��,��ˮ20 mL,��0.100 0 mol��L-1��Ce(SO4)2��Һ�ζ�,�����յ�ʱ����Ce(SO4)2��Һ25.00 mL���йصĻ�ѧ��ӦΪFe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+�������CuCl��Ʒ���������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���̷���FeSO47H2O��������ȱ����ƶѪ����Чҩ��ij��ѧ��ȤС����̷����������µ�̽����
I .���Ʊ���Ʒ��

��С���ɷ���м������������ͭ�������������ʣ�������ͼ��ʾװ���Ʊ�FeSO4��7H2O���壬�������£�
��1��Ԥ�������Ƚ�����м���뵽����Na2CO3��Һ��ϴ�ӣ�Ŀ���� ��Ȼ����м��ˮϴ��2��3�顣
��2����ϴ�Ӻ�ķ���м���뵽Բ����ƿ�У�������ͨ��N2��N2�������� ��
��3���ټ�������ϡ���ᣬ�����¶�50��~80��֮�䣬��ַ�Ӧ��Բ����ƿ��ʣ��Ĺ���Ϊ ��
��4����ȡ��Ʒ�������裨3���з�Ӧ��Ļ�����м�����������ˮ�����ȹ��ˣ� _______________���˳����壬��������ˮϴ��2��3�Σ�������ֽ���������ɣ��ܱձ��档
II.���ⶨFeSO47H2O������
��1����ȡ������Ʒ10.0g������������ϡ�����У����100mL��Һ����Ҫ����������ƽ����ͷ�ιܡ��ձ�����Ͳ�⣬����Ҫ�������У����������ƣ�____________________��_______________________��
��2��ȷ��ȡ25mL��Һ������ƿ�У���0.1000mol/L KMnO4����Һ�ζ�����ζ��յ���жϷ�����______________________________________________��
��3����ͬ���ķ����ζ�3�Σ�ƽ������10.00mL��Һ������Ʒ��FeSO4��7H2O����������Ϊ ��
����֪Mr(FeSO4��7H2O)=278��
��4�����������ƫС����������ڶ���ʱ_________________(����ӡ������ӡ�)������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������о���������ԭ�Ϻϳɸ߷��Ӳ���PET���������£�
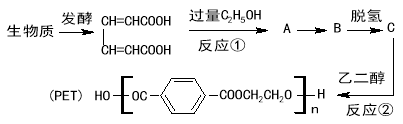
��֪����������Ӧ��
![]()
![]()
��ش��������⣺
��1����Ӧ������ ��Ӧ��
��2��PET������������ ��
��3���л���A��B�Ľṹ��ʽ�ֱ��� �� ��
��4��д����Ӧ�ڵĻ�ѧ����ʽ ��
��5�����л���A��ͬ���칹��F��Һ�еμ��Ȼ�����Һ����ɫ��F�ı��������ĸ�ȡ������һ�ȴ�����ֻ��һ�֣�0.1molF �������Ľ����Ʒ�Ӧ������0.15mol������F�ĺ˴Ź���������4�����շ塣��д��������������F�Ľṹ��ʽ ����дһ�֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ڹ�ҵ���й㷺��;����ش��������⣺
��1����ҵ������N2(g)+3H2(g) ![]() 2NH3(g) H<0�ϳɰ���ijС��Ϊ��̽����������Ը÷�Ӧ��Ӱ�죬��c0 mol/L H2�μӺϳɰ���Ӧ����a��b���������·ֱ�ﵽƽ�⣬��ͼA��
2NH3(g) H<0�ϳɰ���ijС��Ϊ��̽����������Ը÷�Ӧ��Ӱ�죬��c0 mol/L H2�μӺϳɰ���Ӧ����a��b���������·ֱ�ﵽƽ�⣬��ͼA��
�����a���ԣ�b���ܸı�������� ���жϵ�������__________________��
��a�����£�0��t0��ƽ����Ӧ����v(N2)= mol��L-1��min-1�� 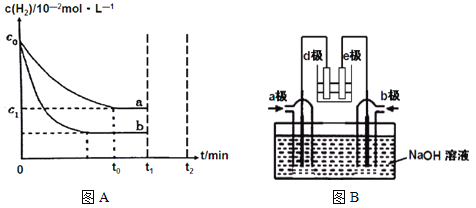
��2����������NH3��NO2���ɵ�صķ���������ʵ����Ч��������������ŷż��ٻ�����Ⱦ�����ܳ�����û�ѧ�ܽ��д����ľ�������ͼB��ʾ��e��Ϊ������
a��ͨ�� ����(�ѧʽ)���жϵ�������___________________________________
��3��ijС����һ���º�ѹ��������9mol N2��23mol H2ģ��ϳɰ���Ӧ��ͼCΪ��ͬ�¶���ƽ�������а����������������ѹǿ��p���Ĺ�ϵͼ������ϵ��T2��60MPa�´ﵽƽ�⡣
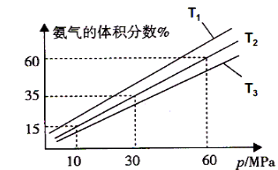
ͼC
�����ж�N2(g)+3H2(g)![]() 2NH3(g)�ﵽƽ�����______(�����)��
2NH3(g)�ﵽƽ�����______(�����)��
a��������ѹǿ���ٷ����仯 b�����������ܶȲ��ٷ����仯
c��v��(N2)=3v��(H2) d����������ƽ����Է����������ٷ����仯
����T1��T2��T3�¶��µ�ƽ�ⳣ���ֱ�ΪK1��K2��K3����K1��K2��K3�ɴ�С������Ϊ ��
�۴�ʱN2��ƽ���ѹΪ MPa������ѹ����ѹ�����ʵ���������
�������ʱ��ƽ�ⳣ��Kp= ������ƽ���ѹ����ƽ��Ũ�ȼ��㣬�������2λ��Ч���ֲ����ϵ�λ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com