
| A、该离子液体中含氨分子 |
| B、硝酸乙基铵水溶液呈碱性 |
| C、硝酸乙基铵水解的离子方程式可表示为:C2H5NH3++2H2O?C2H5NH2?H2O+H3O+ |
| D、同温度下相同物质的量浓度的硝酸乙基铵溶液和硝酸铵溶液前者的pH小 |


科目:高中化学 来源: 题型:
| A、混合气体压强不再发生变化 |
| B、混合气体质量不再发生变化 |
| C、反应中CO与H2的物质的量之比为1:1 |
| D、生成nmolCO的同时生成nmolH2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
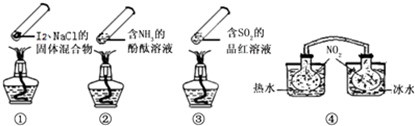
| A、加热时,①上部汇聚了固体碘,说明碘的热稳定性较差 |
| B、加热时,②、③中的溶液均变红,冷却后又都变为无色 |
| C、④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅 |
| D、四个“封管实验”中都有可逆反应发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
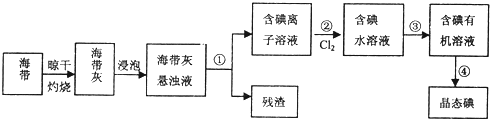
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | 2Na+2H2O=2NaOH+H2↑ 3NO2+H20=NO+2HNO3 | 均为水作氧化剂的氧化还原反应 |
| B | SiO2能与NaOH溶液反应也能与氢氟酸反应 Al2O3能与NaOH溶液反应,也能与盐酸反应 | 两种氧化物均为两性氧化物 |
| C | Cl2+2Br-=2Cl-+Br2 Zn+Cu2+=Zn2++Cu | 均为单质被还原的置换反应 |
| D | Cl2+2FeCl2=2FeCl3 I2+SO2+2H2O=H2SO4+2HI | 均属离子反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | V(烧碱溶液)/mL | V(HCl)/mL | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 2.50 | 36.50 |
| 2 | 20.00 | 1.00 | 35.04 |
| 3 | 20.00 | 2.10 | 36.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(OH-) |
| A、溶液中由水电离出的c(OH-)=1×10-10mol/L |
| B、溶液中c(OH-)+c(NH3?H2O)=0.1mol/L |
| C、与0.1mol/L 的盐酸等体积混合后所得溶液中:c(Cl-)=c(NH4+)+c(NH3?H2O)=0.1mol/L |
| D、原溶液中加入少量的氯化铵晶体或加水稀释,溶液中的c(H+)均增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com