
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。二氧化硫有毒,并且是形成酸雨的主要气体。无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要。完成下列填空:
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。
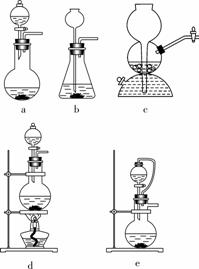
如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,图中可选用的发生装置是 ae (填写字母)。
(2)若用硫酸和亚硫酸钠反应制取3.36 L(标准状况)二氧化硫,至少需要称取亚硫酸钠 18.9 g(保留一位小数);如果已有4.0%亚硫酸钠(质量分数)被氧化成硫酸钠,则至少需称取该亚硫酸钠 19.8 g (保留一位小数)。
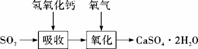
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。石灰-石膏法和碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为SO2+Ca(OH)2===CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O===2CaSO4·2H2O。其流程如下图:
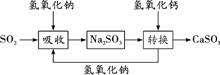
碱法的吸收反应为SO2+2NaOH===Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如下图:

已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.90 |
吸收SO2的成本(元/mol) | 0.027 | 0.232 |
石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是 利用SO2是酸性氧化物,可与碱反应 。和碱法相比,石灰-石膏法的优点是 原料易得,吸收成本低 ,缺点是 吸收速率慢,效率低 。21·世纪*教育网
(4)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示)。
(1)ae (2)18.9 19.8 (3)利用SO2是酸性氧化物,可与碱反应 原料易得,吸收成本低 吸收速率慢,效率低 (4)
解析:(1)用硫酸和亚硫酸钠制取SO2的试剂为固态和液态,反应条件不需加热,可通过控制添加硫酸的速率来控制反应速率,结合装置可知a、e可达到目的。(2)由硫守恒可得:Na2SO3~SO2,因此需称取m(Na2SO3)=126 g·mol-1×3.36 L/22.4 L·mol-1=18.9 g;4 g亚硫酸钠氧化为硫酸钠后质量变为(4×142)/126=4.5 g,则有4.0%亚硫酸钠被氧化为硫酸钠的样品中亚硫酸钠的质量分数为:96/100.5=95.5%,因此称取变质样品的质量应为:18.9g÷95.5%=19.8 g。(3)石灰-石膏法与碱法吸收SO2都是利用SO2是酸性氧化物可与碱反应的性质来吸收SO2的;利用题中已知和有关信息可知采用石灰—石膏法所用原料易得、成本低等,但因Ca(OH)2碱性弱,导致吸收速率慢、效率低。


科目:高中化学 来源: 题型:
下列说法不正确的是
A.盛有被KCl饱和 溶液浸泡过的琼脂的U型管,可用作原电池的盐桥
溶液浸泡过的琼脂的U型管,可用作原电池的盐桥
B.Al3+能水解为Al(OH)3胶体,明矾可用作净水剂
C.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
D.甲醛能使蛋白质变性,可用作食品防腐剂
查看答案和解析>>
科目:高中化学 来源: 题型:
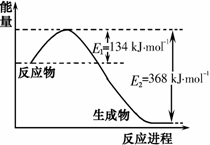
氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。(1)下图是1 mol NO2(g)和1 mol CO(g)反应生成CO2(g)和NO(g)过程中能量变化示意图,写出NO2和CO反应的热化学方程式 _______ 。
(2)已知:N2(g)+ O2(g)= 2 NO(g) △H = +180 kJ • mol-1
2NO(g)+2 CO(g)= N2(g) + 2 CO2(g) △H = -746 kJ • mol-1
则反应CO(g) + O2(g) = CO2(g)的 △H = kJ • mol-1
O2(g) = CO2(g)的 △H = kJ • mol-1
(3)在固定体积的密闭容器中,1.0×103 kPa时,发生反应 N2(g)+3H2(g) 2NH3(g)
2NH3(g)
△H<0 ,其平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 51 | K1 | K2 |
① K1 K2(填写“>”、“=”或“<”)
②下列各项能说明上述合成氨反应一定达到平衡状态的是 (填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.NH3的浓度保持不变
c.容器内压强保持不变 d.混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色溶液中可能含有I-、NH 、Cu2+、SO
、Cu2+、SO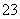 ,向该溶液中加入少量溴水,溶液仍呈无色,则下列关于溶液组成的判断正确的是( )2-1-c-n-j-y
,向该溶液中加入少量溴水,溶液仍呈无色,则下列关于溶液组成的判断正确的是( )2-1-c-n-j-y
①肯定不含I-; ②肯定不含Cu2+;
③肯定含有SO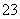 ; ④可能含有I-。
; ④可能含有I-。
A.①③ B.①②③
C.①② D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色气体可能含HCl、HBr、SO2、H2S中的一种或几种,将该气体通入到适量氯水中,恰好反应,无气体剩余。将所得到的无色溶液分装在两支试管中,分别加入酸化的AgNO3溶液和酸化的BaCl2溶液,均产生白色沉淀,则下列判断正确的为( )
A.原气体中一定有SO2,一定无HBr和H2S
B.原气体中可能有H2S
C.原气体中一定有HCl和SO2
D.不能确定有无HCl,但一定无SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
氮的多样性主要体现在含氮化合物及其性质的多样性上,下列说法正确的是( )
A.Fe2+、Mg2+、Cl-、NO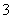 能大量共存于pH=0的溶液中
能大量共存于pH=0的溶液中
B.1 L浓度为1 mol·L-1的NH4Cl溶液中含有NA个NH
C.除去NO中混有的少量NO2,可将混合气体通过盛有水的洗气瓶,再用排空气法收集NO
D.不论是浓硝酸还是稀硝酸,与铜反应均体现出硝酸的酸性和强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.01 mol下列物质分别加入100 mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计)( )
①Na2O2 ②Na2O ③Na2CO3 ④NaCl
A.①>②>③>④ B.①>②>④>③
C.①=②>③>④ D.①=②>③=④
查看答案和解析>>
科目:高中化学 来源: 题型:
向CuSO4溶液中逐滴加入过量KI溶液,观察到产生白色沉淀,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。则下列分析中正确的是( )
A.白色沉淀是CuI2,棕色溶液含有I2
B.滴加KI溶液时,转移1 mol e-时生成1.5 mol白色沉淀
C.通入SO2时,SO2与I2反应,I2作还原剂
D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com