


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
| A、制乙酸乙酯时,把乙醇和乙酸依次加入浓硫酸中 |
| B、纤维素和淀粉都是多糖,二者互为同分异构体 |
| C、煤的干馏是物理变化,煤的气化和液化是化学变化 |
| D、三大合成材料是塑料、合成纤维和合成橡胶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
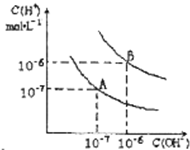 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
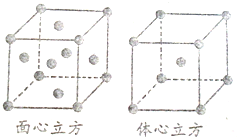 (1)氯化铝常温下为固体,熔点190℃(253kPa),易升华.实验室氯化铝蒸气的密度为11.92g?L-1(已折算成标准状况),据此判断氯化铝晶体为
(1)氯化铝常温下为固体,熔点190℃(253kPa),易升华.实验室氯化铝蒸气的密度为11.92g?L-1(已折算成标准状况),据此判断氯化铝晶体为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
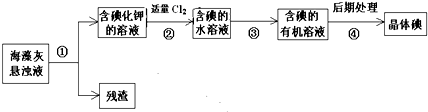
| A、步骤①、③、④的操作分别是过滤、萃取、分液 |
| B、可用淀粉溶液检验步骤②的反应是否进行完全 |
| C、步骤③中加入的有机溶剂是汽油或酒精 |
| D、步骤②之后的碘均为游离态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com