
【题目】下列物质,不能使高锰酸钾溶液褪色的是( )
A.乙烯
B.苯
C.乙炔
D.乙醛
科目:高中化学 来源: 题型:
【题目】已知MgO、MgCl2的熔点分别为2800℃、604℃,将MgO、MgCl2加热熔融后通电电解,都可得到金属镁。海水中含有MgCl2,工业上从海水中提取镁,正确的方法是 ( )
A. 海水![]() Mg(OH)2
Mg(OH)2![]() Mg
Mg
B. 海水![]() MgCl2溶液
MgCl2溶液![]() MgCl2熔融
MgCl2熔融![]() Mg
Mg
C. 海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
D. 海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液
MgCl2溶液![]() MgCl2熔融
MgCl2熔融![]() Mg
Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物N是合成药物洛索洛芬钠(治疗关节炎)的重要中间体,其合成路线如下:
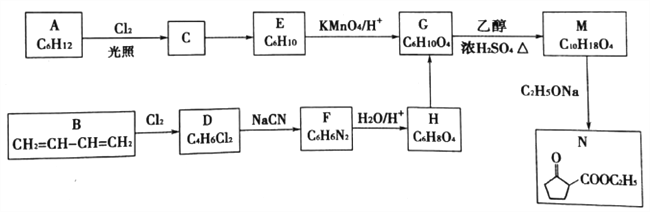
已知:(R、R1、R2均为烃基)
①RCN ![]() RCOOH;②R1CH=CHR2
RCOOH;②R1CH=CHR2 ![]() R1COOH + R2 COOH
R1COOH + R2 COOH
回答下列问题:
(1)①已知烃A的核磁共振氢谱中只有一组峰,A的名称是________。
②N分子中的官能团名称是________。
(2)D→F的反应类型是________。C→E的反应条件是___________。
(3)①写出B与Cl2按物质的量1:1发生反应时主要副产物的结构简式_________。
②合成路线A→G比B→G更优,除副产物少外,还有______和_________的优点。
(4)写出G→M的化学方程式__________________。
(5)写出满足下列条件的H的一种同分异构体的结构简式___________。
①只含有一种官能团;②酸性条件下水解产物只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是一种工业废料,主要成分是MgO(MgO占40%,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质),以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
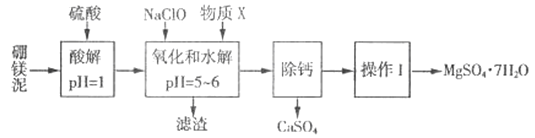
根据题意回答下列问题:
(1)实验中需用1mol/L的硫酸800 mL,若用18.4 mol/L的浓硫酸来配制,则量取浓硫酸时,需使用的量筒规格为_______。(填字母)
A.10 mL B.25 mL C.50 mL D.100 mL
(2)加入的NaClO 可与酸解液中Mn2+ 反应:Mn2+ + ClO-+H2O= MnO2 ↓+ 2H+ + Cl-,溶液中还有一种离子也会被NaClO氧化,该反应的离子方程式为___________。该步骤中,物质X是________(填化学式)。
(3)“滤渣”中除MnO2、CaSO4 外还有_______。(填化学式)
(4)已知MgSO4、CaSO4的溶解度如下表:
温度/℃ | 40 | 50 | 60 | 70 | |
溶解度/g | MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 | |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤:____________。
(5)“操作I”是将滤液经过一系列操作后真空干燥,采用“真空干燥”的原因是________。
(6)实验中提供的硼镁泥共100g,得到的MgSO4·7H2O 为147.6 g,则MgSO4·7H2O的产率为________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钾是一种无色晶体。易溶于水。实验室制备KI晶体的步骤如下:
I.在如图所示的三颈烧瓶中加入127g研细的单质I2和195g30%KOH溶液,搅拌(已知:I2与KOH反应产物之一是KIO3);
II.碘完全反应后,打开分液漏斗中的活塞、弹簧夹,向装置C中通入足量的H2S;
III.反应结束后,向装置C中加入稀H2SO4酸化,水浴加热;
IV.冷却,过滤得KI粗溶液。
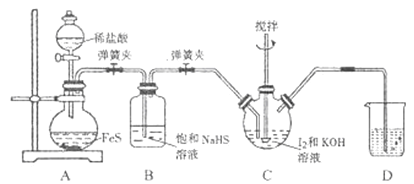
(1)检查装置A气密性的方法是______,步骤I控制KOH溶液过量的目的是______。
(2)装置B的作用是______,装置D中盛放的溶液是______ 。
(3)写出装置C中H2S和KIO3反应的离子方程式: ______ 。
(4)步骤III中水浴加热的目的是除去______ (填化学式)。
(5)由步骤IV所得的KI粗溶液(含SO42-)制备KI晶体的实验方案:边搅拌边向溶液中加入足量的______ (填化学式,下同),充分搅拌、过滤、洗涤并检验后,将滤液和洗涤液合并,加入HI溶液调至弱酸性,在不断搅拌下蒸发至较多固体析出,停止加热,用余热蒸干,得到KI晶体。在测定产品中KI含量时,测得其含量为101.5%,其原因可能是产品中含有______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种利用锂电池“固定CO2”的电化学装置,在催化剂的作用下,该电化学装置放电时可将CO2转化为C和Li2CO3充电时选用合适催化剂,只有Li2CO3发生氧化反应,释放出CO2和O2。下列说法中正确的是
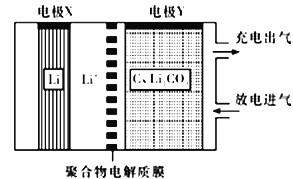
A. 该电池放电时,Li+向电极X方向移动
B. 该电池充电时,每转移0.4mol电子,理论上阳极产生4.48L.CO2
C. 该电池放电时,每转移4mol电子理论上生成1molC
D. 该电池充电时,阳极反应式为C+2Li2CO3-4e-==3CO2↑+4Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液(含有Fe2+、Fe3+、Cu2+)处理和资源回收很有意义。某兴趣小组设计了如下处理方案。
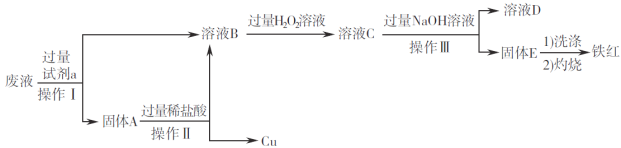
回答下列问题:
(1)固体A的成分是______________(填化学式)。
(2)由溶液B生成溶液C的离子方程式为___________________;检验溶液C中金属阳离子的试剂是____(填名称)。
(3)检验固体E是否洗涤干净的操作为____________________________;灼烧时,用于盛放固体E的仪器为____________________________(填名称)。
(4)铁红用途广泛,可用于焊接钢轨,写出该反应的化学方程式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢在生活、生产、科研中发挥着重要的作用。
Ⅰ.工业上利用吸热反应C(s) +2H2O(g)![]() CO2(g)+2H2(g)来制备氢气。一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应,相关数据如下表:
CO2(g)+2H2(g)来制备氢气。一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应,相关数据如下表:
容器 | 容积/L | 温度/L | 起始量/mol | 平衡量/mol | |
C(s) | H2O(g) | H2(g) | |||
甲 | 2 | T1 | 3 | 4 | 3.2 |
乙 | 1 | T2 | 1.5 | 2 | 1.2 |
(l)T1_______T2 (填“>”、“ =”或“<”)。
(2)T1时达到平衡后再加入lmolH2O(g),达到新平衡后H2(g)的物质的量分数__________(填“增大”、“ 不变”或“减小”);T2时,若起始时乙容器中加入1.5molC(s)、1.2molH2O(g)、0.5molCO2(g)、1.4molH2(g),此时v(正)________v(逆)(填“大 于”、“ 等 于” 或“小于”)。
Ⅱ.CO(g)和H2(g)在一定条件下可合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) △H
CH3OH(g) △H
(3)该反应能量变化曲线如图所示,下列叙述正确的是___________。

A.该反应的△H>0
B.该反应的活化能为419kJ
C.使用催化剂后反应速率加快,△H 不变
D.若改变条件使平衡向正反应方向移动,则CO 的转化率可能增大,可能不变,也可能减小
(4)反应分別在230℃、250℃、270℃进行时,CO的平衡转化率与![]() 的关系如图所示。
的关系如图所示。
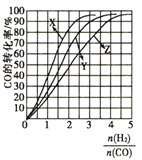
①230℃对应的曲线是_________________,依据是________________。
②向容积为1L的密闭容器中投入1nolCO、3molH2,在上述某温度下进行反应,平衡后测得![]() =
=![]() ,则反应温度为_____________,平衡常数K=_________________。
,则反应温度为_____________,平衡常数K=_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com