
一定温度下,将2mol PCl3和 1mol Cl2充入容积不变的密闭容器中,在一定条件下反应:PCl3+Cl2⇌PCl5,各物质均为气态.达平衡后,PCl5为0.4mol.若此时再加入1molPCl3 和0.5molCl2,相同温度下达到平衡,PCl5的物质的量为x( )
|
| A. | 0.4mol | B. | 0.6mol | C. | 0.4<x<0.6mol | D. | x>0.6mol |
| 化学平衡建立的过程;化学反应的可逆性.. | |
| 专题: | 化学平衡专题. |
| 分析: | 达平衡后再加入1.0mol PC13和0.50mol C12,重新到达的平衡,可以等效为开始加入3.0mol PC13和1.50mol C12到达的平衡,与原平衡相比压强增大,平衡向正反应移动,反应物的转化率增大,故平衡时PC15的物质的量大于原平衡的 |
| 解答: | 解:达平衡后再加入1.0mol PC13和0.50mol C12,重新到达的平衡,可以等效为开始加入3.0mol PC13和1.50mol C12到达的平衡,与原平衡相比压强增大,平衡向正反应移动,反应物的转化率增大,故达新平衡时PC15的物质的量大于原平衡的 故选D. |
| 点评: | 本题考查化学平衡的移动、化学平衡的建立等,难度中等,关键是设计等效平衡建立的途径. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
有一真空瓶质量为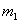 ,该瓶充入空气后质量为
,该瓶充入空气后质量为 。在相同状况下,若改为充入某气体A时,总质量为
。在相同状况下,若改为充入某气体A时,总质量为 。则A的相对分子质量是( )
。则A的相对分子质量是( )
A. ×29 B.
×29 B. ×29 C.
×29 C. ×29 D.
×29 D.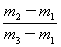 ×29
×29
查看答案和解析>>
科目:高中化学 来源: 题型:
下列既属于氧化还原反应,又属于吸热反应的是( )
A.铝片与稀盐酸反应 B.Ba(OH)2•8H2O与NH4Cl的反应
C.灼热的炭与水蒸气的反应 D.甲烷(CH4)在O2中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)⇌NH3(g)+HI(g);②2HI(g)⇌H2(g)+I2(g)达到平衡时,c(H2)=0.5mol•L﹣1,c(HI)=4mol•L﹣1,则此温度下反应①的平衡常数为( )
|
| A. | 9 | B. | 16 | C. | 20 | D. | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知化学反应①Fe(s)+CO2(g)⇌FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)⇌FeO(s)+H2(g),其平衡常数为K2.在温度973K 和1173K 情况下,K1、K2的值分别如下:
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是 吸热 (填“吸热”或“放热”)反应.
(2)现有反应③:CO2(g)+H2(g)⇌CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=  .
.
(3)能判断反应③已达平衡状态的是 BC .
A.容器中压强不变 B.混合气体中c(CO)不变 C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)根据反应①与②可推导出K1、K2与K3之间的关系式 K3=K1• .据此关系式及上表数据,也能推断出反应③是 吸热 (填“吸热”或“放热”)反应.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是 DF (填写序号).
.据此关系式及上表数据,也能推断出反应③是 吸热 (填“吸热”或“放热”)反应.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是 DF (填写序号).
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度 D.升高温度 E.使用合适的催化剂 F.设法减少CO的量.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是 ( )
A.6.02×1023是阿伏加德罗常数的近似值
B.阿伏加德常数个微粒的物质的量是1mol
C.1mol 12C原子的质量为12g
D.硫酸的摩尔质量是98克
查看答案和解析>>
科目:高中化学 来源: 题型:
①等物质的量的CO和CO2所含原子个数比为 ,质量比为 。
②含硫原子数相同的SO2和SO3的物质的量之比是 ;含氧原子数相同的SO2
和SO3的质量之比是 ,物质的量之比是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于氯及其化合物的性质的说法,正确的是( )
A. 液氯、氯水、次氯酸都具有漂白性
B. 氯气可用向下排空气法收集
C. 氯气能与大多数金属化合,且一般将变价金属氧化至最高价
D. Cl-检验一般先加酸酸化(硝酸或盐酸),再加硝酸银溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com