
分析 经2min达平衡,生成2.4molR,则
2M(g)+3N(g)?Q(g)+3R(g)
开始 2 3 0 0
转化 1.6 2.4 0.8 2.4
平衡 0.4 0.6 0.8 2.4
结合v=$\frac{△c}{△t}$、转化率=$\frac{转化的量}{开始的量}$、物质的量比等于压强比计算.
解答 解:经2min达平衡,生成2.4molR,则
2M(g)+3N(g)?Q(g)+3R(g)
开始 2 3 0 0
转化 1.6 2.4 0.8 2.4
平衡 0.4 0.6 0.8 2.4
(1)用M来表示该反应的化学反应速率是$\frac{\frac{1.6mol}{2L}}{2min}$=0.4mol/(L.min),故答案为:0.4mol/(L.min);
(2)反应前后的压强比为$\frac{2+3}{0.4+0.6+0.8+2.4}$=25:21,故答案为:25:21;
(3)N的转化率是$\frac{2.4mol}{3mol}$×100%=80%,故答案为:80%;
(4)平衡时气体Q所占的体积分数为$\frac{0.8mol}{4.2mol}$×100%=19%,故答案为:19%.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、反应速率计算等为解答的关键,侧重分析与计算能力的考查,注意物质的量与压强的关系,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 锌锰干电池电极总反应为:Zn+2MnO2+2NH4Cl=Mn2O3+ZnCl2+2NH3+H2O,则正极反应为:2MnO2+2H++2e-=Mn2O3+H2O | |
| B. | 将1mol过氧化钠投入含有1molAlCl3的溶液中:6Na2O2+6H2O+4Al3+=4Al(OH)3↓+3O2↑+12Na+ | |
| C. | NaHSO4溶液中加入Ba(OH)2溶液至溶液呈中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 将16.8g 铁粉投入100mL 4.0mol/L的HNO3溶液中(还原产物只有NO)6Fe+20 H++5NO3-=3Fe2++3Fe3++5NO↑+10H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石灰石溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | Na2C03溶液显碱性:C032-+H2O═HCO3-+OH- | |
| C. | 过量铁屑溶于稀硝酸:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| D. | FeI2溶液中通入少量氯气:2Fe2++C12═2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可燃物在燃烧时所显示的火焰颜色 | |
| B. | 所有元素在灼烧时都有焰色反应 | |
| C. | 多种金属或它们的化合物灼烧时所显示的火焰颜色 | |
| D. | 焰色反应是一种化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
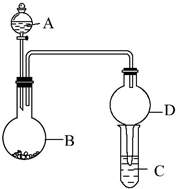 用如图所示装置进行实验(夹持装置已略去).请回答下列问题:
用如图所示装置进行实验(夹持装置已略去).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、NH4+、Cl-、CO32- | B. | K+、Ba2+、NO3-、HCO3- | ||
| C. | Na+、K+、SO42-、SiO32- | D. | Na+、Cu2+、Br -、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,电子由负极通过外电路流向正极 | |
| B. | 标准状况下,反应3.36L氢气,转移电子0.2mol | |
| C. | 氢氧燃料电池能量利用率不等同于氢气直接燃烧的能量利用率 | |
| D. | 产物为无污染的水,属于环境友好电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
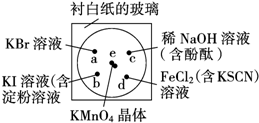 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求,某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L 的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O)
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求,某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L 的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com