
����Ŀ����������(NaN3)����������ˮ�������Ҵ������������ѣ���������ȫ�����е���Ҫ�ɷ֣����ڷ�����ײ��˲��ֽ������������ʹ���ҹ���
��֪��![]() ��
��
ʵ����������ͼװ��ģ�ҵ��NaN3�Ʊ���
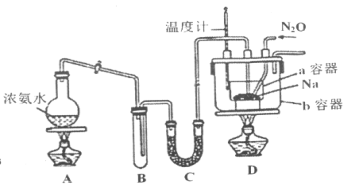
ʵ�������Ʊ�NaN3
(1)װ��C��ʢ�ŵ�ҩƷΪ____________��װ��B����Ҫ������__________________��
(2)Ϊ��ʹa�����������ȣ�װ��D�н�����ԡ������ˮԡ����Ҫԭ����______________��
(3)�������ۻ����Ʒ�Ӧ����NaNH2�Ļ�ѧ����ʽ____________________________________��
(4)N2O����NH4NO3(�۵�169.6��)��240��ֽ��Ƶã�Ӧѡ������巢��װ����________��
ʵ�����������ᴿ
�����ᴿ��Ӧ��ȫ������ȡ��װ��D�еĻ����������²������õ�NaN3���塣
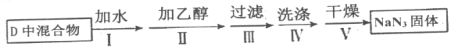
(5)��֪��NaNH2����ˮ��Ӧ����NaOH�Ͱ���������������__________ϴ�ӣ���ԭ����_____________��
ʵ�����������ⶨ
ʵ�����õζ����ⶨ����������Ʒ��NaN3������������
�ٽ�2.500g�������500.00mL��Һ��
��ȡ50.00mL��Һ����ƿ�У�����50.00mL 0.1010![]() (NH4)2Ce(NO3)6 ��Һ��
(NH4)2Ce(NO3)6 ��Һ��
�۳�ַ�Ӧ����Һ��ϡ�ͣ�����Һ�м���8mLŨ���ᣬ����3���ڷƆ���ָʾҺ��0.0500![]() (NH4)2Fe(SO4)2����Һ�ζ�������Ce4+�����ı���Һ�����Ϊ29.00mL���ⶨ�������漰�ķ�Ӧ����ʽ���£�2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2����Ce4++Fe2+=Ce3++Fe3+
(NH4)2Fe(SO4)2����Һ�ζ�������Ce4+�����ı���Һ�����Ϊ29.00mL���ⶨ�������漰�ķ�Ӧ����ʽ���£�2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2����Ce4++Fe2+=Ce3++Fe3+
(6)���Ƶ���������Һʱ�����ձ�������������Ͳ�⣬����Ҫ�õ��IJ���������___________��������������ȷ���ζ����յ���ȡ�ζ�����(NH4)2Fe(SO4)2����Һ���ʱ���ӣ����������ⶨ��Ʒ�е���������������__________(ѡ�ƫ����ƫС�����䡱)��
(7)������NaN3����������Ϊ___________��(������λ��Ч����)
���𰸡���ʯ�� ��������������е�ˮ ��Ӧ��Ҫ��210����220���½��У�ˮԡ���ܴﵽ�����ĸ��� 2Na+2NH3![]() 2NaNH2+H2�� �� ���� NaN3���岻�������ѣ��ܼ�������ʧ����ϴȥ������Ҵ����ʣ��������ӷ��������ڲ�Ʒ���ٸ��� 500mL����ƿ����ͷ�ι� ƫ�� 93.60%
2NaNH2+H2�� �� ���� NaN3���岻�������ѣ��ܼ�������ʧ����ϴȥ������Ҵ����ʣ��������ӷ��������ڲ�Ʒ���ٸ��� 500mL����ƿ����ͷ�ι� ƫ�� 93.60%
��������
ʵ��I��Aװ��Ϊ��ȡ������װ�ã�Bװ��������������������е�ˮ��Cװ��Ϊ���ﰱ������Ϊ��������(NaN3)����������ˮ�����Ա��뱣֤���ﻷ����Dװ��Ϊ��ȡ��������(NaN3)��װ�á���Ӧ֮ǰ��Ҫ�ų�װ���ڵĿ�������ֹNa������е�����������Ӧ��Ӱ����ʣ�ͬʱӦ����β������װ�ã��ݴ˷������(1)��(4)��
ʵ��II������(NaN3)����������ˮ�������Ҵ������������ѣ��������(5)��
ʵ����������������Һ�IJ����ʹ�õ�������ϵζ��������������ķ������(6)��
(7)��ϵζ����̣��������ƺ���������立�Ӧ����0.0500molL-1(NH4)2Fe(SO4)2(���������)����Һ�ζ�������Ce4+����ϻ�ѧ����ʽ������ϵ���㡣
(1)��������������Ũ��ˮ�ֽ�����İ����к��н϶��ˮ��������Bװ�÷������ˮ����������������ˮ��������װ��CΪ���ﰱ����װ�ã����еĸ��������ѡ�ü�ʯ�ң�Bװ��������������������е�ˮ���ʴ�Ϊ����ʯ�ң���������������е�ˮ��
(2) װ��D�еķ�Ӧ��Ҫ��210����220���½��У�ˮԡ���ܴﵽ�����ĸ��£������Ҫ��ԡ���ʴ�Ϊ����Ӧ��Ҫ��210����220���½��У�ˮԡ���ܴﵽ�����ĸ��£�
(3)�������ۻ����Ʒ�Ӧ����NaNH2�Ļ�ѧ����ʽΪ2Na+2NH3![]() 2NaNH2+H2�����ʴ�Ϊ��2Na+2NH3
2NaNH2+H2�����ʴ�Ϊ��2Na+2NH3![]() 2NaNH2+H2����
2NaNH2+H2����
(4)N2O����NH4NO3(�۵�169.6��)��240���ֽ��Ƶã�NH4NO3�ֽ�ʱ�Ѿ��ڻ���ͬʱ�ֽ�����л�����ˮ��Ϊ�˷�ֹˮ�������Թܵײ���ʹ�Թ�ը�ѣ��Թܿ���Ҫ��������б������Ҫ��ֹNH4NO3���£�ֻ��װ��������Ҫ�ʴ�Ϊ������
(5) NaN3���岻�������ѣ����������Բ�������ϴ�ӣ��ܼ���NaN3��ʧ��ͬʱϴȥ������Ҵ����ʣ��������ӷ��������ڲ�Ʒ���ٸ���ʴ�Ϊ�����ѣ�NaN3���岻�������ѣ��ܼ�������ʧ����ϴȥ������Ҵ����ʣ��������ӷ��������ڲ�Ʒ���ٸ��
(6)���Ƶ���������Һʱ�������õ��ձ�������������Ͳ�⣬����Ҫ�õ��IJ���������500mL����ƿ����ͷ�ιܣ�������������ȷ���ζ����յ��ȡ�ζ�����(NH4)2Fe(SO4)2����Һ���ʱ���ӣ��������ı�Һ�����ƫС����(NH4)2Ce(NO3)6�����ʵ���ƫ���������ⶨ��Ʒ�е���������������ƫ�ʴ�Ϊ��500mL����ƿ����ͷ�ιܣ�ƫ��
(7)50.00 mL 0.1010 molL-1(NH4)2Ce(NO3)6 ��Һ�У�n[(NH4)2Ce(NO3)6]=0.1010molL-1��50.00��10-3L=5.05��10-3mol��
29.00mL 0.0500 molL-1(NH4)2Fe(SO4)2����Һ�У�n[(NH4)2Fe(SO4)2]=0.0500molL-1��29.00��10-3L=1.45��10-3mol��
����Ce4++Fe2+=Ce3++Fe3+��֪��(NH4)2Fe(SO4)2����(NH4)2Ce(NO3)6�����ʵ���Ϊ1.45��10-3mol��
����NaN3��Ӧ��n[(NH4)2Ce(NO3)6]=5.05��10-3mol-1.45��10-3mol=3.6��10-3mol��
����2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2����֪��n(NaN3)=n[(NH4)2Ce(NO3)6]=3.6��10-3mol����500.00mL��Һ��(2.500g������)n(NaN3)=3.6��10-3mol��![]() =0.036mol��������NaN3������������=
=0.036mol��������NaN3������������=![]() ��100%=93.60%���ʴ�Ϊ��93.60%��
��100%=93.60%���ʴ�Ϊ��93.60%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪2SO2(g)+O2(g)![]() 2SO3(g) ��H=��197kJ/mol����25��ʱ��������ܱ�������ͨ��2 mol SO2��1 mol O2���ﵽƽ��ʱ�ų�����Q1����25��ʱ�ڴ˺����ܱ�������ֻͨ��1 mol SO2��0.5 mol O2���ﵽƽ��ʱ�ų�����Q2�������й�ϵ��ȷ����
2SO3(g) ��H=��197kJ/mol����25��ʱ��������ܱ�������ͨ��2 mol SO2��1 mol O2���ﵽƽ��ʱ�ų�����Q1����25��ʱ�ڴ˺����ܱ�������ֻͨ��1 mol SO2��0.5 mol O2���ﵽƽ��ʱ�ų�����Q2�������й�ϵ��ȷ����
A. Q2>Q1>197 kJ B. 2Q2<Q1<197 kJ
C. 2Q2=Q1=197 kJ D. 197 kJ> Q1=2Q2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������dz�����ǿ���������㷺����ˮ����ϵͳ����ȡ�����ķ����ܶ࣬���и�ѹ�ŵ編�͵�ⴿˮ��ԭ������ͼ��ʾ�������й�˵���������

A. ���ַ������ǵ��ԭ��
B. ��ѹ�ŵ�����Ŀ����У�������������е���������
C. ��ⴿˮʱ���缫b�����ĵ缫��Ӧ��3H2O��6e����O3����6H����2H2O��4e����O2����4H��
D. ��ⴿˮʱ��H+�ɵ缫b���ۺϹ�������Ĥ����缫a
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����װ���У���Һ�����Ϊ200mL����ʼʱ���������Һ��Ũ�Ⱦ�Ϊ0.1mol/L������һ��ʱ���õ����϶�ͨ����0.02mol eһ������������Һ����ı仯��������������ȷ���ǣ� ��

A. ������Cu��������������Cu������
B. �缫���������ʵ���������<��
C. �缫��Ӧʽ������������4OHһһ4eһ= 2H2O+O2�������и�����2H+ + 2eһ= H2��
D. ��Һ��pH�������䣻������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����20mLŨ��Ϊ0.1mol/L��CH3COOH��Һ����μ���0.1mol/L��NaOH��Һ����ҺpH�ı仯��ͼ��ʾ������˵������ȷ����( )

A. c��ʱ��c(Na+)=c(CH3COO��)
B. b��ʱ��c(Na+)��c(CH3COO��)��c(H+)��c(OH��)
C. d��ʱ��c(Na+)��c(CH3COO��)��c(OH��)��c(H+)
D. ��a�㵽c�������У�c(CH3COO��)��c(H+)=c(Na+)��c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ijͬѧ�����һ��ȼ�ϵ�ز�̽���ȼҵ��ԭ���ʹ�ͭ�ľ���ԭ����������װ���е�XΪ�����ӽ���Ĥ���밴Ҫ��ش�������⣺
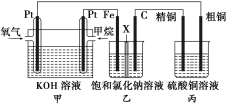
(1)����ȼ�ϵ�صĸ�����ӦΪ__________________________��
(2)ʯī(C)���ĵ缫��ӦΪ______________________________��
(3)���ڱ�״���£���2.24 L�����μӷ�Ӧ������װ�������缫�����ɵ���������Ϊ________L��
(4)ijͬѧ���ü���ȼ�ϵ����Ƶ�ⷨ��ȡƯ��Һ��ʵ��װ��(��ͼ)����������Ư��Һ��aΪ��ص�______�����������Һ�����______________��
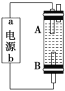
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ����һ�� 2 L ���ܱ������У�X��Y��Z �������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ������ͼ�����ݣ�����д���пհף�

��1���÷�Ӧ��_____________min ʱ�ﵽƽ��״̬��
��2���÷�Ӧ�Ļ�ѧ����ʽΪ___________________________________________��
��3���ӿ�ʼ�� 2min��Z ��ƽ����Ӧ����Ϊ____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.����8�����ʻ�����:
��14N��14C
��16O��18O
������泥�NH4CNO��������[CO(NH2)2]
������ϩ(C60)�ͽ��ʯ
��CH3CH2CH2CH3��CH(CH3)3
��CH3CH2CH3��CH3(CH2)2CH3
��![]() ��
��![]()
��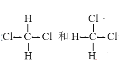
��1����Ϊͬ�����������____________�����ţ���ͬ����
��2����Ϊͬλ�ص���____________��
��3����Ϊͬϵ�����____________��
��4����Ϊͬ���칹�����____________��
��.�ش������й��л���ѧ�����⣺
��5�� �ķ���ʽΪ____________������������������������____________��
�ķ���ʽΪ____________������������������������____________��
��6������Ũ�����Ũ�����ϼ��Ȳ����������ķ�Ӧ����ʽΪ____________����Ӧ������____________��
��7��������ʹ���Ը��������Һ��ɫ����____________��
A.�Ҵ� B.����ϩ C.�� D.�ױ� E.���� F.����ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A.������ֱ���������Է�����3��̼ԭ��Ҳ��һ��ֱ����
B.��ϩ����ԭ�Ӿ���ͬһƽ����
C. ����̼ԭ��һ����ͬһƽ����
����̼ԭ��һ����ͬһƽ����
D.CH3��CH=CH��C��C��CH3����������̼ԭ�ӿ�����ͬһƽ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com