
| A. | 石墨 | B. | 液态HCl | C. | 葡萄糖 | D. | 熔融的Na2CO3 |
分析 电解质是在水溶液里或熔融状态下能导电的化合物,包括酸、碱、盐、活泼金属氧化物和水;
非电解质是在水溶液里和熔融状态下都不能导电的化合物,包括一些非金属氧化物、氨气、大多数有机物(如蔗糖、酒精等);
物质导电的条件:含有自由移动的离子或自由电子;
单质和混合物既不是电解质也不是非电解质.
解答 解:A.石墨是单质,不是电解质,故A错误;
B.液态氯化氢是电解质,但不能导电,故B错误;
C.葡萄糖在水溶液里和熔融状态下都不能导电的化合物,是非电解质,不导电,故C错误;
D.熔融碳酸钠含有自由移动的离子能够导电,是电解质,故D选;
故选D.
点评 本题考查了电解质溶液导电的原因及电解质、非电解质的定义,明确概念是解题关键,注意电解质不一定导电,导电的不一定是电解质,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 14C可用于文物年代的鉴定,14C和12C互为同素异形体 | |
| B. | 淀粉和纤维素都是高分子化合物,且都是非电解质 | |
| C. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| D. | 现代工业生产中芳香烃主要来源于石油化工的催化重整和煤的干馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
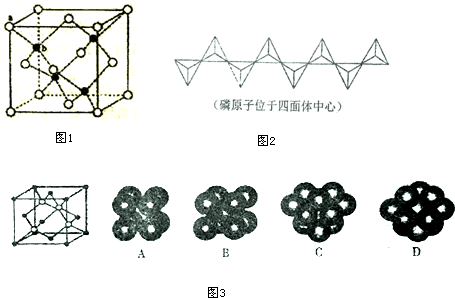
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
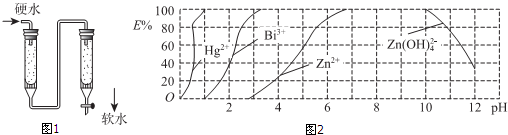
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的密度不再变化 | |
| B. | 混合气体的颜色不变化 | |
| C. | 混合气体中NO2、NO、O2的物质的量之比为2:2:1 | |
| D. | 单位时间生成2n mol NO,同时消耗2n mol NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
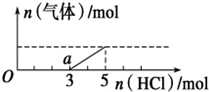 将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )
将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )| A. | O点溶液中所含溶质的化学式为NaOH、Na2CO3 | |
| B. | a点溶液中c (HCO3-)>c (CO32-) | |
| C. | 标准状况下,通入CO2的体积为44.8L | |
| D. | 原NaOH溶液的物质的量浓度为5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的还原性:X>M | |
| B. | Z、M元素最高价氧化物的水化物均为强酸 | |
| C. | X与Y简单离子半径:r(X离子)<r(Y离子) | |
| D. | 化合物ZX2与ZN4含有相同类型的化学键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com